Grundleistungen
Pneumologische Erkrankungen
Pneumologische Erkrankungen
Schlafmedizinische Angebote
Schlafmedizinische Abkärung von
Diagnose und Therapie
Diagnose und Therapie
Prävention und Früherkennung
Prävention und Früherkennung
Fragen und Antworten
Fragen und Antworten
Allgemeine Pneumologie
Pneumologie, auch Pulmologie, Lungenheilkunde genannt; ein Teilgebiet der inneren Medizin, das sich mit den Atmungsorganen und ihren Krankheiten befasst. Sie hat zum Ziel, diese zu verhüten, sie zu erkennen und in erster Linie konservativ zu behandeln, das heißt mit Medikamenten und Physiotherapie. Als interventionelle Pneumologie oder interventionelle Bronchologie überschneidet sie sich mit der Thoraxchirurgie. Angrenzende Gebiete, die sich mit den selben Organen befassen, sind die Radiologie und die Chemotherapie als Teilgebiete der Krebsmedizin (Onkologie). Fachgebiete, die sich mit den angrenzenden Organen befassen, sind die Otorhinolaryngologie für Hals, Nasen und Ohren, die Gastroenterologie für Magen und Darm und die Kardiologie für das Herz. Krankheiten in diesen drei Regionen greifen oft auch auf die Lungen über.
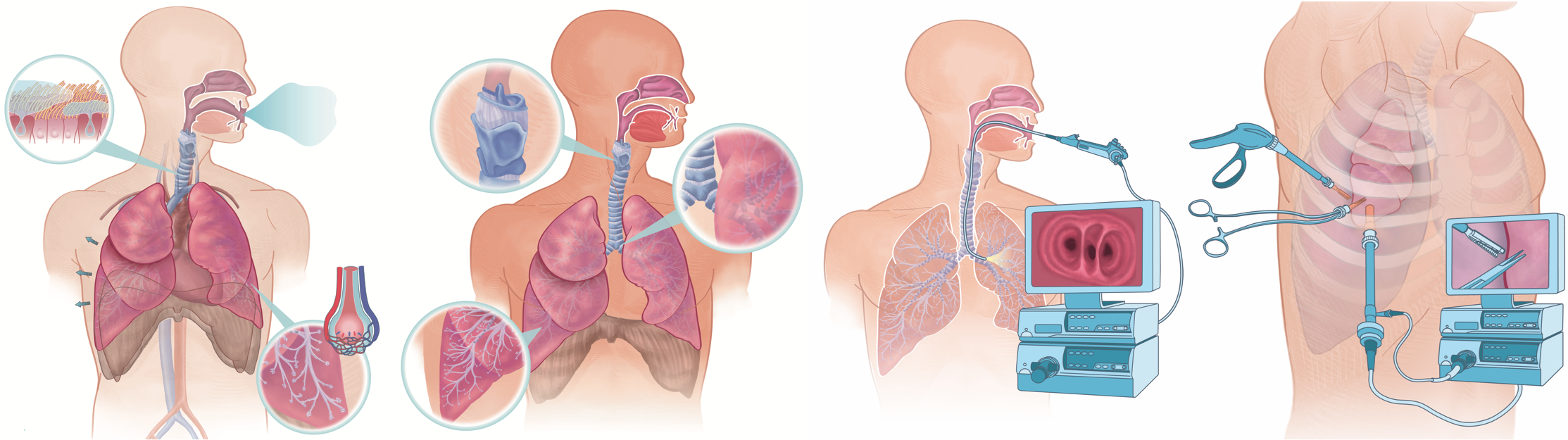
Bronchologie
Die Bronchologie hat sich in den letzten Jahren zu einem eigenständigen Fachgebiet innerhalb der Pneumologie entwickelt. Sie befasst sich mit Krankheiten in den Atemwegen (Bronchien), Lungengewebe und im Brustraum (Pleura). Nase oder Mund bieten einen Zugang zur Luftröhre, den peripheren Bronchien und ins Lungengewebe (Bronchoskopie). Der Brustraum kann durch eine Punktion von aussen erreicht werden, ein Pleureaerguss kann durch eine Punktion entlastet werden, eine Drainagekatheter kann zur dauerenden Ableitung eingelegt werden (weitere Informationen).
Ambulante Lungenrehabilitation
Die pulmonale Rehabilitation ist eine moderne Behandlungsform für chronische Lungenkrankheiten zur Verbesserung der Leistungsfähigkeit und der Lebensqualität. Die pulmonale Rehabilitation wird bei verschiedenen Krankheitsbildern eingesetzt und umfasst ein multidisziplinäres Programm. In der Regel umfasst es 36 ambulante Behandlungen, die nach vorgängiger Kostengutsprache von den Krankenkassen als Pflichtleistung in den akkreditierten Programmen übernommen wird. Das LungenZentrum Hirslanden ist eine von den ersten akkreditierten Institutionen der Schweiz. Unser Programm wird durch Dr. med. Jürg Barandun, ehemals Chefarzt Höhenklinik Davos Clavadel in enger Zusammenarbeit mit der Universitätsklinik Balgrist Move>Med, Olympic Medical Center, unter der Leitung von Dr. med. Walter O. Frey (Olympiaarzt) geführt.
Früherkennung von Lungenkrebs
Raucher und ehemalige Raucher tragen ein grosses Risiko, an Lungenkrebs zu erkranken. Fast alle Lungenkrebskranken sind Raucher oder ehemalige Raucher. Doch Lungenkrebs ist in den meisten Fällen kein Schicksalsschlag, der einen unversehens überfällt und einem keine Chance lässt: Man kann ihn heilen, wenn man ihn rechtzeitig entdeckt.
Gehören Sie als Raucher zur Risikogruppe?
Sie gehören als Raucher zur Risikogruppe, wenn Sie eine oder mehrere der folgenden Fragen bejahen:
Frage 1: Sind Sie 50-jährig oder älter, und haben Sie 20 oder mehr Packungsjahre (z.B. 20 Jahre jeden Tag ein Paket oder 10 Jahre jeden Tag zwei Pakete geraucht usw.)?
Frage 2: Hatten Sie Lungenkrebs, der als geheilt gilt? Ihr Alter spielt in diesem Fall keine Rolle.
Frage 3: Sind Sie 50-jährig oder älter, und haben oder hatten Sie Krebs im Nasen- oder Rachenraum?
Frage 4: Sind Sie 50-jährig oder älter, und sind Sie Krebs erregenden Substanzen ausgesetzt oder ausgesetzt gewesen, wie zum Beispiel regelmässig täglich mehrere Stunden Passivrauch, Asbest, Radon, Dieselrusspartikeln oder Dieseldämpfen? (Zulassung zur Lungenkrebsfrüherkennung in diesen Fällen nur nach besonderer, individueller, vorgängiger Abklärung.)
Frage 5: Sind Sie 50-jährig oder älter, und haben oder hatten Sie zwei oder mehr Verwandte ersten Grades (Eltern oder Kinder oder Geschwister), die an Lungenkrebs erkrankt sind?
Wenn Sie eine oder mehrere der obigen Fragen bejahen, empfehlen wir Ihnen eine Untersuchung; sie dauert nur eine Viertelstunde.
Gehören Sie als Ex-Raucher zur Risikogruppe?
Sie gehören als Ex-Raucher zur Risikogruppe, wenn Sie eine oder mehrere der folgenden Fragen bejahen:
Frage 1: Sind Sie 50-jährig oder älter, und haben Sie 20 oder mehr Packungsjahre (z.B. 20 Jahre jeden Tag ein Paket oder 10 Jahre jeden Tag zwei Pakete geraucht usw.), und sind Sie weniger als zehn Jahre Ex-Raucher, rauchen beispielsweise seit zwei oder neun Jahren nicht mehr?
Frage 2: Hatten Sie Lungenkrebs, der als geheilt gilt? Ihr Alter spielt in diesem Fall keine Rolle.
Frage 3: Sind Sie 50-jährig oder älter, und haben oder hatten Sie Krebs im Nasen- oder Rachenraum?
Frage 4: Sind Sie 50-jährig oder älter, und sind Sie Krebs erregenden Substanzen ausgesetzt oder ausgesetzt gewesen, wie zum Beispiel regelmässig täglich mehrere Stunden Passivrauch, Asbest, Radon, Dieselrusspartikeln oder Dieseldämpfen? (Zulassung zur Lungenkrebsfrüherkennung in diesen Fällen nur nach besonderer, individueller, vorgängiger Abklärung.)
Frage 5: Sind Sie 50-jährig oder älter, und haben oder hatten Sie zwei oder mehr Verwandte ersten Grades (Eltern oder Kinder oder Geschwister), die an Lungenkrebs erkrankt sind?
Wenn Sie eine oder mehrere der obigen Fragen bejahen, empfehlen wir Ihnen eine Untersuchung; sie dauert nur eine Viertelstunde.
Interessiert?
Folgen Sie bitte diesem Link für weitere Informationen.
Thoraxchirurgie
Die Thoraxchirurgie ist die chirurgische Fachrichtung, welche sich mit der operativen Behandlung der Erkrankungen der Lunge, der Brustwand, der Speiseröhre, der Schilddrüse, des Zwerchfelles und der Schilddrüse befasst. In diesem Fachbereich arbeiten wir sehr intensiv mit den Thoraxchirurgen vom Chirurgischen Zentrum Zürich.
Folgende Untersuchungen/Operationen werden bei uns durchgeführt:
Tumorchirurgie bei Lungenkrebs -> Lobektomie, Pneumonektomie, Mediastinoskopie
Operative Behandlung des Mesotheliomes -> Totale Pleuropneumonektomie
Thymus -> Thymektomie
Lungenoperationen bei Lungenkrankheiten -> Wedgeresektion, Lobektomie
Operationen beim Emphysem -> Bullektomie, Lungenvolumenresektion (LVRS)
Operationen bei Pneumothorax -> Pleurektomie, Pleurabrasio, Wedgeresektion
Operationen bei Erguss -> Pleurodese
Operationen bei Vereiterung des Brustraumes -> Dekortikation
Operationen an der Speiseröhre -> Oesophagektomie
Operationen am Herzbeutel -> Perikardfenestrierung und Perikardektomie
Schilddrüsenoperationen -> Threoidektomie, Hemithyreoidektomie subtotale Thyreoidektomie und Enukleationen
Operation der Nebenschilddrüsen -> Parathyreoidektomie
Operationen des Zwerchfelles -> Plication des Zwerchfelles und Resektionen
Operationen bei Zwerchfellbrüchen und Sodbrennen -> Fundoplictio nach Nissen und Toupet, Heller Myotomie bei Achalasie
Operationen bei Hyperhidrose (vermehrtes Schwitzen der Achselhölen/Hände) -> Thorakoskopische Sympathektomie
Schlafmedizin
Ein neues Fachgebiet mit spezifischer Diagnostik zur effizienten Abklärung und Therapie von Schlaf-Wach-Störungen.
Obwohl Schlafstörungen vielfältigste Ursachen haben, sind die vorgebrachten Hauptklagen über Tagesmüdigkeit, Schläfrigkeit und Schlaflosigkeit bei den Betroffenen immer ähnlich. Um die Symptome einer Schlafstörung richtig einordnen zu können, ist daher eine schlafmedizinische Differenzialdiagnostik notwendig. Diese besteht aus der umfassenden Erhebung der Symptome und der Krankengeschichte in einer Schlafsprechstunde und bei gegebener Indikation aus einer überwachten Schlafregistrierung, einer Polysomnographie.
Die unter Experten gebräuchliche internationale Klassifikation teilt die Störungen des Schlafes in über 90 verschiedene Krankheitsbilder ein. Nach sorgfältiger Diagnosestellung durch den Spezialisten gibt es für fast alle Schlafprobleme spezifische und wirksame Therapien. Wegen der Vielfältigkeit der Schlafstörungen und deren Behandlungsstrategien wurde in den letzten Jahren deutlich, dass Schlafprobleme und schlafabhängige Beschwerden am effizientesten durch Spezialisten abgeklärt werden, die in der Diagnostik und Therapie aller Schlafstörungen ausgebildet sind. Auf dem fachübergreifenden Zusammenführen von Fachwissen basieren die Konzepte, die der Schlafmedizin zum erfolgreichen Durchbruch als eigene Spezialdisziplin verholfen haben.
Vertiefte Informationen finden Sie in unserer Online-Broschüre zum Herunterladen.
Falls Sie den Verdacht auf eine Schlafapnoe (Atemstillstände während dem Schlaf) oder vermehrte Tagesschläfrigkeit (Einschlafneigung bei monotonen Tätigkeiten) haben, benützen Sie unseren Online-Test.
Wir pflegen eine enge Zusammenarbeit mit dem Zentrum für Schlafmedizin Hirslanden.
Hausärzte, klinische Fachpersonen und medizinische Institutionen können Patienten schriftlich, telefonisch oder mit einem speziellen Anmeldeformular für eine somnologische Abklärung anmelden.
Tel. 043 499 52 11
Fax 043 499 52 10
info(at)sleepmed.ch
Anmeldeformular für Ärzte
Kontaktinformationen für Patienten:
Zentrum für Schlafmedizin
Hirslanden Zürich
Forchstrasse 420
8702 Zollikon
Tel : 043 499 52 11
Fax : 043 499 52 10
info(at)sleepmed.ch
Schlafapnoe
Wenn häufige Atemstillstände im Schlaf zu einem fragmentierten und nicht erholsamen Schlaf führen, so spricht man von einem Schlafapnoe-Syndrom. Vereinzelte Atempausen, die im Schlaf nicht häufiger als fünfmal pro Stunde auftreten, sind dagegen unbedenklich und können auch im gesunden Schlaf beobachtet werden.
Obstruktive Schlafapnoe
Obstruktive Atempausen entstehen durch den Verschluss der oberen Atemwege im Bereich des Gaumens und des Zungengrundes infolge starker Erschlaffung der Muskulatur im Schlaf. Häufigste Symptome des obstruktiven Schlafapnoe-Syndroms sind lautes, unregelmässiges Schnarchen (crescendo-decrescendo) mit Luftschnappen, in Serie auftretende Atempausen von mindestens 10 Sekunden Dauer, erhöhte Einschlafneigung am Tag, unruhiger Schlaf, Kopfdruck und Abgeschlagenheit beim Aufwachen, mehrmaliges nächtliches Wasserlösen, starkes Schwitzen im Schlaf und Bluthochdruck. Trotz genügend langer Schlafzeit fühlt man sich am Morgen unausgeruht und die Tagesvigilanz ist deutlich eingeschränkt (Einschlafneigung bei monotonen Tätigkeiten und langen Autofahrten). Das Schlafapnoe-Syndrom kommt im mittleren Alter bei Männern mit einer Häufigkeit von bis zu 4%, bei Frauen bis zu 2% vor.
Zentrale Schlafapnoe
Zentrale Atempausen entstehen durch vorübergehendes Aussetzen der Atemimpulse vom Gehirn (Atemzentrum im verlängerten Rückenmark). Die Atemwege bleiben bei dieser Form der Atemstörung offen und die Atmung setzt bei Bedarf an Sauerstoff ungehindert wieder ein. Bei zentralen Atemstörungen findet sich oft ein periodisches Atemmuster mit vielen Atempausen, die sich negativ auf die Schlafqualität auswirken. Zentrale Atemstörungen werden bei Patienten mit Herzinsuffizienz, sowie bei älteren Personen vermehrt gefunden.
Gemischte Schlafapnoe
Kommen obstruktive und zentrale Schlafapnoe während der gleichen Schlafperiode vor, wird es als gemischtes Schlafapnoe-Syndrom bezeichnet.
Abklärung und Behandlung
Der Schweregrad und die Art einer Atemstörung im Schlaf macht eine Registrierung (z.B. nächtliche Langzeitpulsoxymetrie, Polygraphie, Polysomnographie) des Schlafs erforderlich. Für die Behandlung des Schlafapnoe-Syndroms existieren mehrere wirksame Therapiemethoden (CPAP-Therapie, Protrusions-Schiene, Verhinderung der Rückenlage).
Die Überdrucktherapie mittels CPAP-Gerät und Nasenmaske ermöglicht selbst in schweren Fällen eine unbehinderte Atmung im Schlaf mit Normalisierung der Schlafqualität. Die Leistungsfähigkeit und Lebensqualität vieler Schlafapnoe-Patienten werden unter optimaler Behandlung auf eindrückliche Art verbessert. Gleichzeitig werden medizinische Beschwerden wie Bluthochdruck, Herzrhythmusstörungen und saures Aufstossen in der Nacht durch die Therapie der Schlafapnoe positiv beeinflusst.
weitere Diagnosen
Die unten aufgeführten weiteren schlafmedizinischen Diagnosen werden in enger Zusammenarbeit mit unserem Zentrum für Schlafmedizin unter der Leitung von Dr. med. Cristina Zunzunegui abgeklärt.
Schlaflosigkeit (Insomnie)
Schnarchen
Übermässige Tagesschläfrigkeit
Narkolepsie
Restless legs-Syndrom
Periodische Bewegungen der Beine im Schlaf
Nächtliche Dyspnoe (Aufwachen mit Atemnot und Erstickungsangst)
Parasomnien (Sprechen, Schreien, Stöhnen, Zähneknirschen, Essen oder gefährliches Verhalten im Schlaf, Bettnässen, Albträume usw.)
Schlafwandeln und Nachtschreck (Pavor nocturnus)
Schlafstörungen im Alter
Für weiterführende Informationen verweisen wir auf den Selbstest und auf die Diagnosenliste unseres Zentrums für Schlafmedizin.
Pneumologische Verfahren
- Bodyplethysmographie
- Broncho-alveoläre Lavage
- Bronchoskopie
- Bronchoskopische Ballondilatation
- Bronchoskopische Lungenvolumenreduktion
- CO-Diffusionsmessung
- Diagnostische Bronchoskopie
- Elektromagnetische Navigations-Bronchoskopie
- Endobronchiale Kryotherapie
- Endobronchiale Lasertherapie
- Endobronchiale Ultraschallbiopsie (EBUS)
- Flexible Bronchoskopie
- Früherkennung von Lungenkrebs
- Heim-Sauerstofftherapie
- Inhalationstechniken
- Kognitive Verhaltenstherapie
- Künstliche Beatmung
- Lungenfunktion
- Metacholin-Bronchoprovokationstest
- Navigations-Bronchoskopie
- Pulmonale Rehabilitation
- Radialer endobronchialer Ultraschall (Minisonde)
- Rauchstoppberatung
- Starre Bronchoskopie
- Therapeutische Bronchoskopie
- Transbronchiale Kryobiopsie
- Vasodilatations-Therapie
Zweitmeinung
Vier Augen sehen mehr als zwei, und eine zweite fachliche Meinung dient Ihrer Sicherheit. Für viele Probleme gibt es mehrere Lösungen. Deshalb ist es manchmal von Vorteil, die Meinung eines weiteren Spezialisten einzuholen - besonders vor grösseren Eingriffen und wenn Sie als Patient Zweifel haben, ob Ihnen die vorgeschlagenen Massnahmen in jeder Beziehung entsprechen. Die Ärzte des LungenZentrums hören Ihnen unvoreingenommen zu und bringen das neueste medizinische Wissen ein, wenn sie Sie beraten.
nach Alphabet
- ARDS (Akutes Atemnotsyndrom)
- Alpha-1-Antitrypsin-Mangel (ALPHA-1)
- Angeborene hämorrhagische Teleangiektasie
- Asthma
- Beatmung-verbundene Lungenentzündung (Ventilator associated pneumonia - VAP)
- Bronchiale Erkrankung
- Bronchiektasen
- Bronchitis
- Brust- und Lungenfellerkrankungen
- Brustschmerzen
- Bruxismus
- Chronisch-obstruktive Lungenerkrankung (COPD)
- Chronische Bronchitis
- Chronische granulomatöse Erkrankung
- Chronische thromboembolische Erkrankung
- Chronischer Husten
- Erkrankung der Pulmonalklappe
- Fortgeschrittenes Schlafphasen-Störungs-Syndrom (ASPD)
- Granulomatose mit Polyangiitis
- Hepatopulmonales Syndrom
- Hypersensitivitäts-Pneumonitis (EAA)
- Idiopathische Hypersomnie
- Insomnie
- Interstitielle Lungenerkrankung (ILD)
- Karzinoide der Lunge
- Kombinierte Schlafapnoe
- Kryptogen organisierende Pneumonie (COP)
- Lungenfibrose
Primärprävention
Die Primärprävention hat zum Ziel, die Gesundheit zu fördern und zu erhalten und die Entstehung von Krankheiten zu verhindern. Maßnahmen der Primärprävention (Aufklärung, Erziehung, Information, politische Aktionen) sollte in einer möglichst frühen Lebensphase einsetzen. Hierzu gehört zum Beispiel die Vermeidung von Risikofaktoren wie Alkohol- und Nikotinkonsum, insbesondere verstärkte Maßnahmen zum Nichtraucherschutz oder gesundheitsbewusste Erziehungsmaßnahmen, die bei Kindern die Lust und Freude an gesunder Ernährung und körperlichen Aktivitäten wecken sollen.
Das LungenZentrum Hirslanden hat zusammen mit Prof. Dr. med. Felix Gutzwiller (ehem. National- und Ständerat des Kanton Zürich) und der Stiftung pro aere aktiv an der Umsetzung des Bundesgesetz zum Schutz vor dem Passivrauchen mitgearbeitet.
Für weiterführende Informationen wenden Sie sich an die Stiftung pro aere.
Sekundärprävention
Die Sekundärprävention soll das Fortschreiten einer Krankheit durch Frühdiagnostik und -behandlung verhindern. Sie umfasst Maßnahmen zur frühzeitigen Entdeckung von Veränderungen, die zu Krankheiten führen bzw. greift in Risikosituationen ein. Screening-Untersuchungen (z.B. Mammographie bei der Brustkrebsvorsorge, Darmspiegelungen zur Darmkrebsprävention) bei scheinbar Gesunden auf das Vorliegen bestimmter symptomloser Krankheitszeichen oder -vorzeichen zielen darauf ab, Krankheiten im Frühstadium zu erkennen und sie durch rechtzeitige Behandlung möglichst zur Ausheilung oder zum Stillstand zu bringen.
Das LungenZentrum Hirslanden in Zusammenarbeit mit der Stiftung für Lungendiagnostik ist in der Schweiz die einzige Institution, die sich aktiv in der Früherkennung des Lungenkrebs engagiert. Das LungenZentrum Hirslanden ist auch aktives Mitglied von I-ELCAP und ist in der Expertenkommission der Europäischen Union zur Erarbeitung von Richtlinien zur Früherkennung von Lungenkrebs vertreten.
Die Rauchstoppberatung, gerade bei jungen und gesunden Leuten, stellt eine typische sekundärpräventive Massnahme dar. Das LungenZentrum Hirslanden ist durch das RauchstoppZentrum sehr aktiv involviert und bietet Ihnen eine intensive Rauchstoppberatung an.
Tertiärprävention
Als Tertiärprävention wird die Verringerung der Schwere und der Ausweitung von bereits manifest gewordenen Erkrankungen bezeichnet; sie beinhaltet aber auch die Rückfallsprophylaxe sowie die Prävention von Folgestörungen bei bereits bestehenden Krankheiten bzw. eingetretenen Ereignissen. Tertiäre Maßnahmen betreffen Menschen, die bereits an einer Krankheit in einem fortgeschrittenen Stadium leiden. Ziel ist, die Funktionsfähigkeit und Lebensqualität weitestgehend wiederherzustellen bzw. zu erhalten.
Das LungenZentrum Hirslanden engagiert sich intensiv für Patienten mit COPD mit Schwerpunkt Raucherentwöhnung, medikamentöse und operative Therapie und Verbessung der Lebensqualität durch ambulante pulmonale Rehabilitation .
Häufig gestellte Fragen
Ja.
Ambulante Patienten werden unabhängig von Ihrer Versicherungsklasse in den Praxen des LungenZentrum Hirslanden behandelt.
Allgemeinversicherte stationäre Patienten können im Kanton Zürich nur an der Klinik Hirslanden aufgenommen werden, alle anderen Privatkliniken bieten diese Aufnahmemöglichkeit nicht an!
Das LungenZentrum Hirslanden wurde Mitte 1998 gegründet und ist seit über 20 Jahren für die umfassende Betreuung von allen Patienten mit Lungenerkrankungen an der Klinik Hirslanden verantwortlich. Wir haben bewusst unsere medizinischen Service auf die Klinik Hirslanden ausgerichtet und sind nicht noch an anderen Kliniken tätig. Wir sind auch im Notfall für Sie jederzeit verfügbar.
Das pneumologische Ärzteteam umfasst:
Dr. med. Jürg Barandun
Dr. med. Karl Klingler
Dr. med. Andreas Piecyk
Wir sind 365 Tage, 24h für Sie da!
Es besteht eine enge Zusammenarbeit mit den Thoraxchirurgen des Chirurgischen Zentrum Zürich:
Prof. Dr. med. Othmar Schöb
Prof. Dr. med. Rolf Schlumpf
Prof. Dr. med. Paul Schneider
Es besteht eine enge Zusammenarbeit mit dem Zentrum für Schlafmedizin:
Dr. phil. Daniel Brunner
li. phil. Daniela Jansen-Müller
PD Dr. med. Rositsa Neumann
Das LungenZentrum steht allen Patienten im ambulanten und stationären Setting unabhängig von der Versicherungsklasse zur Verfügung.
Nein, es besteht auch die Möglichkeit sich direkt bei uns anzumelden.
Es liegt uns viel an einer engen Zusammenarbeit mit Ihrem Hausarzt, weshalb es empfehlenswert ist, Ihren Hausarzt zu informieren. Insbesondere wenn Sie in einem Hausarztmodell versichert sind, muss die Zuweisung über Ihren Hausarzt erfolgen. Normalerweise erstellen wir nach Diagnose und Therapieeinleiting einen Hausarztbericht, den wir Ihnen auch gerne in Kopie zustellen.
Ja, in Notfallsituationen dürfen Sie auch ohne Termin vorbeikommen. Um längere Wartezeiten zu verhindern, empfehlen wir ein kurzes Telefonat mit unserem Empfang Tel. 044/387 30 00. Wir bemühen uns jederzeit, so effizient wie möglich zu arbeiten und Ihre Wartezeit so kurz wie möglich zu halten.
Ja, Ihre Sicherheit ist uns sehr wichtig, es ist immer ein Arzt des LungenZentrums während den Sprechstundenzeiten im Hause. Wir haben bewusst verzichtet in anderen Kliniken gleichzeitig tätig zu sein, da dadurch die Kontinuität der Behandlung nicht zu jedem Zeitpunkt durch einen Facharzt gewährleistet wird.
1. Warum gegen Grippe impfen?
Die alljährliche Grippeimpfung im Herbst bietet (zusammen mit allgemeinen Hygienemassnahmen wie Händedesinfektion, Husten- und Niesdisziplin) den bestmöglichen Schutz vor der Grippe und ihrer Komplikationen im bevorstehenden Winter.
2. Welches sind die Zielgruppen für eine Grippeimpfung?
a. Personen mit erhöhtem Risiko für Grippekomplikationen: Senioren ab 65 Jahren, Patienten mit chronischen Erkrankungen, Frühgeborene ab dem 6. Lebensmonat für die ersten zwei Winter nach der Geburt und Schwangere (während der gesamten Schwangerschaftsdauer),
b. sowie deren Kontaktpersonen in Beruf und Familie (z.B. Medizinal-, Pflege- und Krippenpersonal, Tagesmütter oder im selben Haushalt lebende Personen)
c. und Personen, die regelmässigen Kontakt mit Säuglingen unter 6 Monaten haben.
Alle übrigen Personen, welche sich aus beruflichen oder privaten Gründen schützen möchten, können selbstverständlich ebenfalls vom Angebot am Nationalen Grippeimpftag profitieren.
3. Was ist der Nationale Grippeimpftag und wer organisiert ihn?
a. Der Nationale Grippeimpftag soll als besonders sichtbarer Event zu Beginn der
Grippesaison den Sinn und den Zeitpunkt der Grippeimpfung in Erinnerung rufen. Zudem können sich alle Impfinteressierten an diesem Tag überall in der Schweiz (ohne Voranmeldung bei den teilnehmenden Praxen und zu einem empfohlenen Pauschalpreis von 30 CHF) impfen lassen.
b. Der Grippeimpftag wird vom Kollegium für Hausarztmedizin in Zusammenarbeit mit den Fachgesellschaften der Schweizerischen Haus- und KinderärztInnen (SGAIM und SGP) organisiert und logistisch sowie finanziell unterstützt vom Bundesamt für Gesundheit (BAG). Im Jahr 2018 findet er am Freitag, 9. November statt.
4. Wie und wo kann ich mich am Grippeimpftag impfen lassen?
Interessierte Personen können die Adressen impfender HausärztInnen in ihrer Umgebung bequem auf der Website des Kollegiums für Hausarztmedizin (via Startseite) finden (ab September verfügbar). Nach kurzer Befragung und Information über die Grippeimpfung wird der Interessent vom Arzt oder einer Praxisassistentin geimpft. Der empfohlene Pauschalpreis (30 CHF) ist danach bar zu bezahlen. Personen mit einem erhöhten Komplikationsrisiko können sich den Betrag von ihrer Krankenkasse rückerstatten lassen (sofern die Franchise bereits erreicht wurde).
Impfung gegen Pneumokokken verfügbar.
Pneumokokken-Erkrankungen werden durch Bakterien aus der Familie der Streptokokken hervorgerufen. Sie sind weltweit verbreitet und werden von Mensch zu Mensch übertragen. Je nach Region der Welt und abhängig vom Alter sind verschiedene Pneumokokken-Stämme für unterschiedliche Krankheiten mit zum Teil lebensbedrohlichen Verläufen verantwortlich. So verursachen sie beispielsweise die Mehrzahl aller bakteriellen Lungenentzündungen.
Pneumokokken werden wie ein grippaler Infekt durch Tröpfcheninfektion übertragen - beispielsweise beim Husten oder Niesen. Die Bakterien finden sich im Nasen-Rachen-Raum vieler Menschen, ohne dass diese daran erkranken. Daher können sie auch von Gesunden weitergegeben werden.
Warum Pneumokokken bei manchen Menschen plötzlich Krankheiten auslösen und bei anderen nicht, ist nicht genau bekannt. Auch Gesunde können betroffen sein. Bei geschwächter Körperabwehr – zum Beispiel nach einer Viruserkrankung oder bei chronischen Erkrankungen – passiert dies jedoch leichter. Säuglinge und Kleinkinder sowie auch ältere Menschen erkranken häufiger an Pneumokokken. Denn mit zunehmendem Alter lassen die Abwehrkräfte des Körpers nach und chronische Krankheiten nehmen zu.
Pneumokokken können verschiedene Erkrankungen auslösen - darunter Nasennebenhöhlen-, Mittelohr-, Hirnhautentzündung oder Blutvergiftung. Darüber hinaus sind sie für 20 bis 50 Prozent aller durch Bakterien verursachten Lungenentzündungen bei älteren Erwachsenen verantwortlich. Einige dieser Erkrankungen können lebensbedrohlich verlaufen. Bei schwerem Verlauf stirbt etwa jeder Zehnte der Erkrankten an den Folgen der Pneumokokken-Infektion. Besonders gefährdet sind Menschen mit geschwächtem Immunsystem.
Pneumokokken-Erkrankungen können zwar mit Antibiotika behandelt werden. Allerdings nehmen Resistenzen zu, so dass die Medikamente schlechter anschlagen. Der Schutz durch Impfung wird daher immer wichtiger.
Die Pneumokokkenimpfung ist in erster Linie indiziert für Personen jeden Alters mit erhöhtem Risiko einer Pneumokokkenerkrankung oder bei über 65-Jährigen von uns empfohlen:
Chronische Krankheiten:
- Herzinsuffizienz
- Chronisch obstruktive Lungerkrankung (COPD), schweres Asthma, Bronchiektasen durch Antikörpermangel
- Leberzirrhose
- Anatomische und funktionnelle Asplenie, Sichelzellanämie
- Niereninsuffizienz, nephrotisches Syndrom
- Schlecht eingestellter Diabetes mit Herz- oder Niereninsuffizienz
Neoplasien: Lymphome, Leukämie, Myelome
Transplanation: Kandidaten und Empfänger einer solide Organtransplantation, Stammzellenempfänger
Störungen des Immunsystems:
- Autoimmunerkrankungen, die wahrscheinlich eine Immunsuppression erfordern
- Medikamentöse Immunsuppression
- HIV-Infektion
- Immundefizienz, z.b. Variables Immundefektsyndrom, Polysaccharid-Antikörpermangel
Frühgeburt (< 33. Schwangershaftwoche oder Geburtsgewicht < 1500g)
Cochleaimplantat (in situ oder geplant)
Schädelbasisfraktur / -Missbildung
Nebenwirkungen:
Häufig kommt es durch die Anregung der körpereigenen Abwehr zu einer Rötung oder Schwellung an der Einstichstelle, die auch schmerzen kann. Ebenso können in den ersten drei Tagen nach der Impfung Allgemeinsymptome wie beispielsweise Fieber, Kopfschmerzen, Abgeschlagenheit, Muskel- und Gelenkschmerzen auftreten. Solche Impfreaktionen klingen in der Regel nach ein bis drei Tagen wieder ab.
Schwere Nebenwirkungen sind selten. Eine allergische Reaktion (z. B. Nesselsucht) ist möglich. Sehr selten kann sich die Zahl der Blutplättchen (verantwortlich für die Blutgerinnung) vorübergehend verringern.
Impfstoffe:
In der Schweiz sind 2 Impfstoffe für Erwachsene verfügbar. Pneumovax (23-valent) muss alle 5-6 Jahre wiederholt werden oder Prevenar (13-valent) muss nur 1x verabreicht werden, wird nicht wiederholt. Es muss aber bei diesem Impfstoff (Prevenar) ein Abstand von 1 Jahr zu einer Pneumovax-Impfung eingehalten werden, kann aber gleichzeitig mit einer Grippe-Impofung verabreicht werden.
Früherkennung von Lungenkrebs
Raucher und ehemalige Raucher tragen ein grosses Risiko, an Lungenkrebs zu erkranken. Fast alle Lungenkrebskranken sind Raucher oder ehemalige Raucher. Doch Lungenkrebs ist in den meisten Fällen kein Schicksalsschlag, der einen unversehens überfällt und einem keine Chance lässt: Man kann ihn heilen, wenn man ihn rechtzeitig entdeckt.
Gehören Sie als Raucher zur Risikogruppe?
Sie gehören als Raucher zur Risikogruppe, wenn Sie eine oder mehrere der folgenden Fragen bejahen:
Frage 1: Sind Sie 50-jährig oder älter, und haben Sie 20 oder mehr Packungsjahre (z.B. 20 Jahre jeden Tag ein Paket oder 10 Jahre jeden Tag zwei Pakete geraucht usw.)?
Frage 2: Hatten Sie Lungenkrebs, der als geheilt gilt? Ihr Alter spielt in diesem Fall keine Rolle.
Frage 3: Sind Sie 50-jährig oder älter, und haben oder hatten Sie Krebs im Nasen- oder Rachenraum?
Frage 4: Sind Sie 50-jährig oder älter, und sind Sie Krebs erregenden Substanzen ausgesetzt oder ausgesetzt gewesen, wie zum Beispiel regelmässig täglich mehrere Stunden Passivrauch, Asbest, Radon, Dieselrusspartikeln oder Dieseldämpfen? (Zulassung zur Lungenkrebsfrüherkennung in diesen Fällen nur nach besonderer, individueller, vorgängiger Abklärung.)
Frage 5: Sind Sie 50-jährig oder älter, und haben oder hatten Sie zwei oder mehr Verwandte ersten Grades (Eltern oder Kinder oder Geschwister), die an Lungenkrebs erkrankt sind?
Wenn Sie eine oder mehrere der obigen Fragen bejahen, empfehlen wir Ihnen eine Untersuchung; sie dauert nur eine Viertelstunde.
Gehören Sie als Ex-Raucher zur Risikogruppe?
Sie gehören als Ex-Raucher zur Risikogruppe, wenn Sie eine oder mehrere der folgenden Fragen bejahen:
Frage 1: Sind Sie 50-jährig oder älter, und haben Sie 20 oder mehr Packungsjahre (z.B. 20 Jahre jeden Tag ein Paket oder 10 Jahre jeden Tag zwei Pakete geraucht usw.), und sind Sie weniger als zehn Jahre Ex-Raucher, rauchen beispielsweise seit zwei oder neun Jahren nicht mehr?
Frage 2: Hatten Sie Lungenkrebs, der als geheilt gilt? Ihr Alter spielt in diesem Fall keine Rolle.
Frage 3: Sind Sie 50-jährig oder älter, und haben oder hatten Sie Krebs im Nasen- oder Rachenraum?
Frage 4: Sind Sie 50-jährig oder älter, und sind Sie Krebs erregenden Substanzen ausgesetzt oder ausgesetzt gewesen, wie zum Beispiel regelmässig täglich mehrere Stunden Passivrauch, Asbest, Radon, Dieselrusspartikeln oder Dieseldämpfen? (Zulassung zur Lungenkrebsfrüherkennung in diesen Fällen nur nach besonderer, individueller, vorgängiger Abklärung.)
Frage 5: Sind Sie 50-jährig oder älter, und haben oder hatten Sie zwei oder mehr Verwandte ersten Grades (Eltern oder Kinder oder Geschwister), die an Lungenkrebs erkrankt sind?
Wenn Sie eine oder mehrere der obigen Fragen bejahen, empfehlen wir Ihnen eine Untersuchung; sie dauert nur eine Viertelstunde.
Interessiert?
Folgen Sie bitte diesem Link für weitere Informationen.
ARDS (Akutes Atemnotsyndrom)
Damit wird das Akute Atemnotsyndrom bezeichnet, eine lebensgefährliche Erkrankung, bei der die Lungen nicht richtig arbeiten können. ARDS wird durch Schäden in der Kapillarwand hervorgerufen, die entweder auf eine Erkrankung oder physische Verletzung zurückzuführen sind. Durch diese Schädigung wird die Kapillarwand undicht, was zu einem Flüssigkeitsstau und letztlich zum Kollaps der Lungenbläschen führt. Dadurch ist die Lunge nicht länger in der Lage, Sauerstoff und Kohlendioxid auszutauschen.
Akutes Atemversagen ist ein Begriff, der oft gemeinsam mit ARDS verwendet wird. Allerdings ist dieser Terminus breiter gegriffen und bezeichnet das Versagen der Lunge aus welchen Gründen auch immer, zum Beispiel durch chronisch obstruktive Lungenerkrankung.
Weiterführende Literatur finden Sie hier.
Alpha-1-Antitrypsin-Mangel (ALPHA-1)
Ist eine Erbkrankheit, die bewirkt, dass die Leberzellen das Enzym Alpha-1-Antitrypsin (AAT) fehlerhaft oder in zu geringer Menge bilden oder freisetzen. Unbehandelt kann sich die Erkrankung je nach Ausprägung früher oder später an Lunge und Leber – in selteneren Fällen auch auf der Haut und weiteren Organen – manifestieren. So ist ALPHA-1 die häufigste Ursache für genetisch bedingte Lebererkrankungen bei Kindern. Bei Erwachsenen geht der ALPHA-1 mit einem erhöhten Risiko einher, eine COPD (chronisch obstruktive Lungenkrankheit) zu entwickeln – insbesondere ein so genanntes panlobuläres Lungenemphysem , das alle Bereiche der Lunge betreffen und zu gravierender Behinderung und frühem Tod führen kann.
Der ALPHA-1 ist unter Menschen mit europäischer Abstammung eine der häufigsten Erbkrankheiten. In Europa sind davon etwa 2,5 von 10.000 Menschen betroffen; ALPHA-1 kommt also etwa so häufig vor wie Typ-1-Diabetes oder Cystische Fibrose (Mukoviszidose). Die homozygote Form der ALPHA-1, bei welcher der betreffende Gendefekt in doppelter Ausführung (also von beiden Elternteilen geerbt = homozygot) vorhanden ist, tritt mit einer geschätzten Häufigkeit von 0,01 bis 0,02 Prozent auf und betrifft in Schweiz ungefähr 1000 Menschen.
Trotzdem ist ALPHA-1 im Bewusstsein von Allgemeinärzten und Patienten zu wenig verankert und wird daher oft nicht rechtzeitig erkannt und behandelt. So wird ALPHA-1 nach wie vor zu selten als Ursache für chronische Bronchitis und schweres Lungenemphysem in Erwägung gezogen. Und das obwohl ALPHA-1 die häufigste genetisch bedingte Ursache des Lungenemphysems ist und in den USA, zum Beispiel, bei etwa zwei Prozent der Lungenemphysem-Patienten ein Mangel an AAT nachweisbar ist. Schätzungen zufolge wird ALPHA-1 möglicherweise bei nur 5-10 Prozent der Betroffenen diagnostiziert und bleibt somit bei den meisten unerkannt. Bei Patienten mit schwerem ALPHA-1, die an einer Umfrage teilnahmen, lagen durchschnittlich 7,2 Jahre zwischen dem Auftreten von Krankheitszeichen und der ersten Diagnose. Bei einer optimalen Therapie liegt die Lebenserwartung der Patienten bei 60-68 Jahren, wenn sie nicht rauchen.
Therapeutisch kann 1-2-wöchentlich eine Substitutionsbehandlung mit humanem (vom Menschen) Alpha-1-Proteinaseinhibitor intravenös vorgenommen werden, welches die Entwicklung des Lungenemphysems verzögert.
Angeborene hämorrhagische Teleangiektasie
Auch Rendu-Osler-Weber-Syndrom genannt, handelt es sich um eine autosomal-dominant vererbte Bindegewebserkrankung der Gefäße mit variabler lokalisierter Ausbildung von angiodysplastischen Läsionen aufgrund einer Störung des Gefäßwandkollagens.
Die Folgen sind u.a. Dilatation (= Ausbildung von Teleangiektasien) und Malformation kleinster Gefäße der Häute und Schleimhäute mit konsekutiver Entwicklung arteriovenöser Shunts. Mit einer Häufigkeit von 1:2000-1:40000, ohne geschlechterspezifische Unterschiede.
Es manifestiert sich hierbei ein Defekt des Endoglin-Gens auf Chromosom 9q3 bzw. der Aktivin-Rezeptor-ähnlichen-Kinase auf Chromosom 12q13. Homozygote Formen sind nicht lebensfähig, heterozygote sind klassische Merkmalsträger; die Erkrankung ist an die Blutgruppe 0 gekoppelt.
Der Morbus Osler weist einen stadienhaften Krankheitsverlauf auf. Erste klinische Symptome sind Epistaxis und Zahnfleischbluten, die bereits in der Kindheit und jungem Erwachsenenalter auftreten.
Im weiteren Krankheitsverlauf sind stecknadelkopf- bis reiskornkgroße rote Flecken an Haut und Schleimhäuten, insbesondere im Bereich des Gesichts, der Lippen, perioral, der Zunge, nasopharyngeal, an den Händen, aber auch im gesamten GI- und Urogenialtrackt nachweisbar. Diesbezüglich manifestieren sich u.a. Hämaturie, rezidivierende gastrointestinale Blutungen, chronische Eisenmangelanämie etc.
Manifestation von pulmonal arteriovenösen Malformationen und Shuntbildungen, die Thromben und Bakterien am Kapillarfilter der Lunge vorbeiführen und somit zu zerebralen und viszeralen Embolien sowie Abszedierungen (z.B. apoplektischer Insult, Hirnabszesse etc.) führen.
Organbeteiligung
Lungenbeteiligung: Es können sich arteriovenöse Lungenfisteln entwickeln, die eine Symptomatik mit Dyspnoe, Hämoptysen, Zyanose, Trommelschlegelfinger bis hin zur pulmonalen Hypertonie und Herzinsuffizienz (= High-output-heart-failure) hervorruft.
Leberbeteiligung: Findet man in bis zu 80% der Fälle mit asymptomatischen arteriovenösen Fisteln. Jedoch kann es durch Shuntbildungen zwischen der A. hepatica und Lebervenen bzw. Pfortader und Lebervenen zur portalen Hypertension mit Aszites, Ösophagusvarizen, Splenomegalie bis hin zur Leberzirrhose kommen.
ZNS-Beteiligung: Infolge der zerebralen Teleangiektasien, arteriovenösen Malformationen (AVM), Aneurysmen und kavernösen Angiomen können sich Migräne- und Krampfanfälle, Synkopen bis hin zur Apoplexie und Subarachnoidal- bzw. Intrazerebralblutungen manifestieren.
In einigen Fällen besteht eine Assoziation zur familiären juvenilen Polyposis.
Asthma
Chronische Entzündung der Atemwege mit Auftreten von chronischem Husten und beziehungsweise Atemnot. Asthma ist eine chronische Krankheit. Die Beschwerden wechseln sich mit längeren ruhigen Phasen ab, in denen die Patienten keine oder wenige Symptome spüren. Atemnot-Anfälle sind für die Betroffenen oft sehr ernst; sie fürchten zu ersticken und ringen verzweifelt nach Luft. Mehr noch als das Einatmen ist das Ausatmen erschwert. Die Symptome lassen sich jedoch durch Prophylaxe, Medikamente und Schulung für richtiges Verhalten gut beherrschen.
Richtig behandelte Asthmatiker können sogar erfolgreich Spitzensport treiben. Die häufigsten Auslöser sind Husten oder Atemnot erzeugende Stoffe wie Pollen, Tierhaare oder Milbenkot, Passivrauchen oder andere Arten der Luftverschmutzung (Ozon, Abgase), warme oder kalte Luft, körperliche Anstrengung usw.
Die Anfälligkeit für Asthma ist zum Teil auch genetisch bedingt. Lassen sich bei der Abklärung keine Allergene finden, spricht man von einem Intrinsic Asthma. Anders als bei der chronisch-obstruktiven Lungenkrankheit (COPD) kann sich die Verengung der Bronchien schnell zurückbilden.
Die Asthmaschulung lehrt die Patienten, Substanzen und Situationen zu meiden, die Anfälle auslösen und instruiert sie in der richtigen Handhabung der Medikamente zur Vorbeugung und beim Einsatz während eines Asthmaanfalls.
Die Asthmatherapie umfasst den Einsatz von Medikamenten, mit denen die chronische Entzündung und die eventuelle Verengung der Bronchien behandelt werden. Bei der einen Hälfte der Asthmatiker zeigt sich ausschließlich chronischer Husten als Symptom, bei der anderen Hälfte unterbrechen Phasen von Atemnot den chronischen Husten.
Therapieansätze
Asthmaschulung, Schulung für Menschen, die an Asthma leiden. Dabei lernen sie, gefährliche Asthmaanfälle sicher zu meistern, wie sie solche vermeiden können und wie sie mit der chronischen Krankheit ein möglichst normales Leben führen können. Ein sehr wichtiger Punkt ist die Compliance, das heißt die Bereitschaft des Asthmatikers, die Medikamente regelmäßig anzuwenden, auch dann, wenn er keine Symptome spürt. Je besser die Compliance, desto besser wird der Asthmatiker seine Krankheit beherrschen und desto kleiner ist die Gefahr, dass sie sich verschlimmert und sein Leben bedroht.
Im Notfall ist es wichtig, das Gerät zum Inhalieren griffbereit zu haben und schnell und sicher damit umgehen zu können. Diese Sicherheit ist entscheidend, denn nur sie kann Fehler als Folge von Panik verhindern. Disziplin ist daher ein wichtiger Punkt. Sie lässt sich auch im Sport üben, wobei sich viele Sportarten gut für Asthmatiker eignen, auch solche, die Herz und Lungen fordern: Es geht darum, die Anstrengung zu dosieren, und ihr nicht auszuweichen. Zur Schulung gehört auch die richtige Atemtechnik (Lippenbremse) bei beginnen der Atemnot. So lassen sich Anfälle verzögern oder eventuell sogar verhindern.
Asthmatherapie, vordringlich und grundsätzlich am wirksamsten ist es, die Auslöser von Asthmaanfällen zu erkennen und sie auszuschalten. In vielen Fällen, so bei Pollen (Heuschnupfen) und an deren Auslösern in der Umwelt, wird das aber nicht immer möglich sein. Zur Behandlung von Asthma verfügt der Arzt über eine große Vielfalt von Medikamenten in verschiedensten Formen und mit sehr unterschiedlichen Wirkungen. Auch eine Desensibilisierung kommt komplementär in Frage, um den Körper nach und nach dergestalt an die Auslöser zu gewöhnen, dass er immer weniger heftig darauf reagiert. Bei der Behandlung wird unterschieden zwischen der Basistherapie, die das Risiko von Anfällen mindert, und der Bedarfsmedikation, mit der die Symptome der Anfälle bekämpft werden. Ein Notfallplan verhindert, dass Anfälle die Gesundheit oder das Leben gefährden können.
Stufentherapieplan
Anweisung für Asthmapatienten, die Dosis der Medikamente an den jeweiligen Schweregrad der Erkrankung anzupassen.
Medikamente zur Asthmatherapie gliedern sich in drei Gruppen
Entzündungshemmer (inhalatives Kortison und Leukotrien-Antagonisten) bekämpfen die bei allen Asthmaformen ausgelöste entzündliche Reaktion der Bronchien. Bei dieser Controllertherapie ist die dauernde Anwendung von Entzündungshemmern notwendig.
Bronchodilatatoren, auch Reliever genannt, erweitern die verengten Bronchien und lindern so die Atemnot.
Biologika: Die Unterteilung des nicht-kontrollierten Asthmas in Subtypen hat zur genauen Charakterisierung der Entzündungsauslöser geführt. Die angefügte Publikation ergibt einen umfassenden Überblick über den Stand der Forschung und aktuelle und zukünftige spezialärztliche Behandlungen bisher nur im Erwachsenenalter.
Weiterführende Literatur finden Sie hier.
Beatmung-verbundene Lungenentzündung (Ventilator associated pneumonia - VAP)
Die Beatmung, Versorgung der Lungen mit frischer Luft bei einem Atemstillstand (Apnoe), das heißt bei fehlender spontaner Atmung in einer für die Gesundheit bedrohlichen Situation; meist im Rahmen einer Erste-Hilfe-Leistung oder bei einer geplanten oder notfallmäßigen Operation. Sind keine Geräte vorhanden, ist eine Atemspende oder Mund-zu-Nase-Beatmung das einzige Mittel. Der erste und wichtigste Schritt besteht darin, die Atemwege zu kontrollieren und eventuell vorhandene Fremdkörper zu entfernen. Dies kann eine Aspiration und eine Atemwegsobstruktion verhindern. Geeignete Lagerung hält die Atemwege frei. Nachdem die Rettungskräfte eingetroffen sind, setzen diese dem Patienten einen Beatmungsbeutel mit Gesichtsmaske auf, der eventuell durch → Sauerstoff unterstützt wird. Die meisten Techniken der Beatmung arbeiten mit Überdruck: Luft wird von außen in die Lungen gepresst. Nur bei bestimmten Formen maschineller Beatmung setzt man auch Unterdruck ein.
Die künstliche oder maschinelle Beatmung der Lungen über einen Schlauch (Tubus), der in die Luftröhre (Trachea) eingeführt wird. Eine Maschine dosiert den dazu nötigen Überdruck, die Menge der Luft und ihren Gehalt an Sauerstoff. Dies ist bei den meisten Operationen mit Narkose (Anästhesie) die gängigste Methode. Verantwortlich dafür ist der Anästhesist.
Die Ventilator-assoziierte Pneumonie (VAP) tritt bei Patienten mit akutem respiratorischem Versagen unter maschineller Beatmung auf, wobei zum Zeitpunkt der Intubation (Beginn der Beatmung) noch kein Hinweis auf eine Lungenentzündung (Pneumonie) vorgelegen hat. Die VAP ist eine häufige Kom- plikation auf Intensivstationen, die rund 15-35% aller beatmeter Patienten betrifft (Eggimann P; Intensive Care Med 2003; 29: 2086), wobei die angegebenen Raten abhängig vom untersuchten Pa- tientenkollektiv und den Diagnosekriterien (in manchen Studien klinischer Verdacht und Röntgen-Veränderungen, in anderen zwingend auch invasiver Keimnachweis mit einem Bürstenabstrich (protected specimen brush) [PSB] oder einer bronchoalveolären Lavage [BAL]) schwanken. Die VAP hat eine erhöhte Morbidität, Mortalität und Kosten zur Folge (Warren DK; Crit Care Med 2003; 31:1312).
Die antibiotische Therapie bei Patienten mit VAP muss differenziert betrachtet werden, die Wahl des Antibiotikums hängt von vielen Faktoren wie Krankenhausaufenthaltsdauer, vorbestehender und laufender antibiotischer Therapie, Schwere der Krankheit, sowie lokaler bakteriologischer und antimikrobieller Resistenzmuster ab. Eine wohlüberlegte Behandlungsstrategie ist von Anfang an entscheidend, da eine inadäquate initiale anti-mikrobielle Therapie mit einer erhöhten Mortalität assoziiert ist.
Bronchiale Erkrankung
Das Bronchialsystem ist Teil der Atemwege und fasst die Luftwege innerhalb der Lunge zusammen. Die Atemluft wird über Mund oder Nase aufgenommen, gelangt in die Luftröhre (Trachea), die sich dann in die beiden Hauptbronchien aufteilt. Jeder Hauptbronchus befindet sich innerhalb eines Lungenflügels. Da die linke Lunge kleiner als die rechte ist und nur zwei und nicht wie die rechte Lunge drei Lungenlappen hat, teilt sich der linke Hauptbronchus in zwei und der rechte in drei kleinere Bronchien (sog. Lappenbronchien).
Die Lappenbronchien wiederum teilen sich in noch kleinere Bronchien (sog. Segmentbronchien), die sich zunächst in die Rami subsegmentales und dann in die Bronchiolen weiter aufteilen und schließlich in den Lungenbläschen (Alveolen) enden. Nur der letzte, untere Teil der Bronchiolen und die Alveolen sind am Gasaustausch beteiligt. Im Gegensatz zu diesem respiratorischen Abschnitt dient der übrige Teil (Hauptbronchus, Bronchien, oberer Abschnitt der Bronchiolen) nur der Leitung der Luft (konduktiver oder luftleitender Abschnitt). Bronchiale Erkrankungen betreffen somit das Bronchialsystem.
Bronchiektasen
Dauerhaft sackförmig oder zylindrisch erweiterte Stellen an den Bronchien (Atemwege); in diesen können sich Schleim und Erreger ansammeln. Beim Atmen fallen sie oft in sich zusammen und behindern so den Luftstrom. Sie entstehen meist als Folge einer chronischen Bronchitis oder anderen schweren Infektionen der Bronchien (sekundäre Bronchiektasen), wie Bronchiolitis, Pneumonie, Tuberkulose, Masern, Keuchhusten und andere kindliche Infekte. Sie können aber auch angeboren sein (primäre Bronchiektasen).
Symptome: Chronischer Husten mit Auswurf (Sputum), bisweilen blutig (Hämoptoe), ständiges Fieber, Schwäche, Trommelschlägelfinger, Uhrglasnägel.
Vorbeugung: Gewissenhafte Überwachung bei kindlichen Atemwegsinfekten, sorgfältiger Schutz vor Schadstoffen, insbesondere vor Tabakrauch.
Behandlung: Antibiotika, Bronchodilatatoren bei verengten Atemwegen, Atemtherapie; wenn lokalisiert auf einen Lungenlappen oder Lungensegment operabel, chirurgisch entfernen.
Bronchitis
Entzündung der Schleimhaut der Bronchien, ausgelöst durch eine Infektion mit Viren und/oder Bakterien, durch Allergie oder Reiz, durch schädliche Gase, Flüssigkeiten, Aerosole, Tabakrauch, Asbest oder andere Stäube. Man unterscheidet zwei Formen des Verlaufs. Eine akute Bronchitis entwickelt sich schnell und heftig, meist ist sie durch Mikroorganismen verursacht. Sie verschwindet wieder, sobald die Mikroorganismen nicht mehr aktiv sind. Eine chronische Bronchitis entwickelt sich langsam und schleichend über eine lange Zeit hinweg und wird meist durch Schadstoffe in der Luft, insbesondere durch das Rauchen, verursacht. Sie kann nach und nach das Lungengewebe bleibend schädigen, wie bei der chronisch-obstruktiven Lungenerkrankung (COPD). Die Behandlung richtet sich nach der Art der Ursachen und der Schwere der Krankheit.
Akute Bronchitis, infektiös: Die Entzündung beginnt meist in Nase (Rhinitis), Rachen, Kehlkopf und Luftröhre und breitet sich dann in die Bronchien aus; falls sie deren feinste Verästelungen erreicht, handelt es sich um eine Bronchiolitis. Auslöser sind anfangs meist Viren, seltener Bakterien; doch können letztere die durch Viren geschwächten Bronchien leichter befallen. Bronchitis ist deshalb oft eine Mischinfektion aus Viren und Bakterien (Pertussis=Keuchhusten), Windpocken, Scharlach, Diphtherie. Bei geschwächtem Immunsystem (zB. AIDS oder IgG-Subklassenmangel) können auch Pilze, die normalerweise nur die Mundhöhle befallen (Soor), bis in die Bronchien vordringen und dort eine Bronchitis auslösen.
Akute Bronchitis, nicht infektiös: Die Entzündung entsteht durch eine allergische Reaktion, Asthma bronchiale oder wenn giftige Gase wie Schwefeldioxid, Stickoxid, Ozon oder Kohlenwasserstoffe (Abgase, Smog) die Schleimhaut der Bronchien reizen oder wenn eine Herzinsuffizienz zu einem Blutstau in den Lungen (Lungenödem) führt.
Symptome: Husten mit Auswurf, Fieber, Schmerzen in der Brust. Das Sputum ist zäh, zu Beginn eher schleimig und weißlich, später gelblich durch die Abwehrzellen des Immunsystems, grünlich durch Bakterien, in schweren Fällen bräunlich oder rötlich durch kleine Mengen von Blut. Atemgeräusche: trockenes oder feuchtes Rasseln.
Chronische Bronchitis: Husten und Auswurf an den meisten Tagen während mindestens je drei Monaten in zwei aufeinander folgenden Jahren (Definition der WHO, 1966). Ursache ist in den meisten Fällen das Rauchen, seltener die Wirkung von Schadstoffen am Arbeitsplatz oder von Abgasen in der Umwelt. Daher auch Raucherhusten genannt. Die Bronchialschleimhaut reagiert auf diese Reize, indem sie mehr Schleim produziert. Die empfindlichen Flimmerhärchen sterben ab, so dass sich mehr Schleim in den Bronchien ansammelt, was den Hustenreiz auslöst. Im liegengebliebenen Schleim können sich Bakterien besser einnisten, was Infektionen begünstigt. Falls diese andauern, zerstören sie mit der Zeit das Lungengewebe; es entwickelt sich eine chronisch-obstruktive Lungenkrankheit (COPD).
Brust- und Lungenfellerkrankungen
werden auch pleurale Erkrankungen genannt. Das Brustfell ist die Innenauskleidung des Brustkorbs (Pleura patietalis), das Lungenfell bedeckt die Lunge (Pleura viszeralis), dazwischen ist der sog. Pleuralspalt, welcher durch eine Körperflüssigkeit das reibungsarme Gleiten der beiden Felle gegeneiander gewährleistet.
Bei Erkrankungen des Brust- oder Lungenfells kommt es zur Ausbildung eines Pleuraerguss (Flüssigkeitsansammlung zwischen dem Brrust- und Lungenfell), welches aufgrund einer Kompression der Lunge (Flüssigkeit hat eine höhere Dichte als Luft in der Lunge) zu Atemnot und Druckgefühl im Brustbereich führen kann.
Häufige Erkrankungen des Brust- oder Lungefells sind:
Beim Pneumothorax dringt durch eine Verletzung des inneren oder äußeren Pleurablattes Luft in den Pleuraspalt ein. Der physiologische Unterdruck wird dadurch aufgehoben und die Lunge zieht sich zusammen, es kommt zu einem teilweisen oder kompletten Kollaps des betroffenen Lungenflügels.
Eine Entzündung der Pleura wird als Pleuritis bezeichnet. Sie ist meist eine Folge verschiedener Erkrankungen der Lunge, die auf das Brustfell übergreifen, sie kann aber auch selbständig entstehen.
Bei einem Pleuraerguss, der einseitig oder doppelseitig sein kann, sammelt sich Flüssigkeit zwischen den beiden Pleurablättern. Eine Vielzahl von Erkrankungen (zB. virale, bakterielle oder tuberkulöse Infekte, Herzinsuffizienz, krebsartige Erkrankungen) kann die Ursache dafür sein.
Wenn Blut in den Pleuraspalt eindringt, nennt man das Hämatothorax, Ursachen sind zB. Rippenserienfrakturen und Lungenrisse.
Auch Tumoren können von der Pleura ausgehen. Das seltene Pleuramesotheliom wird meist durch Asbest verursacht und ist eine anerkannte Berufskrankheit.
Brustschmerzen
Der Brustschmerz (Thoraxschmerz) ist ein unspezifisches Symptom mit vielfältigen Ursachen mit unterschiedlicher Gefährlichkeit. Beteiligte Organe sind Herz, Lunge, Brust- und Lungenfell, Speiseröhre, Muskel- und Skelettsystem des Brustkorbes.
Ursachen im Zusammenhang mit dem Herz (Herzinfarkt, Herrhythmusstörungen) und der Lunge (Lungenembolien) müssen möglichst rasch ausgeschlossen werden:
Herz
Symptome eines Herzinfarkt (Schweizerische Herzstiftung):
Heftiger beengender Druck und klemmende Schmerzen in der Brustmitte von mindestens 15 Minuten Dauer, oft ausstrahlend in Schultern und Arme (meist links), den Hals, Unterkiefer oder Oberbauch
Übelkeit, Schwäche, Schwitzen, eventuell kalte blasse Haut
Angstgefühl, Atemnot
Achtung: Bei Frauen und älteren Patienten sind folgende Symptome nicht selten alleinige Anzeichen eines Herzinfarkts: Atemnot, unerklärliche Übelkeit und Erbrechen, Druck in Brust, Rücken oder Bauch.
Ein Herzinfarkt ist ein Notfall, der eine unverzügliche Spitaleinweisung erfordert -> Sanität bestellen unter Telefon: 144 (für die ganze Schweiz).
Lunge
Symptome einer Lungenembolie:
Plötzlich einsetzende Atemnot
Atemabhängige Schmerzen (eher stechender Charakter)
Leicht blutiger Auswurf
Herzrasen, beschneunigte Herzfrequenz
Plötzliche Bewusstlosigkeit bei zentralen Lungenembolien
Eine Lungenembolie ist ein Notfall, sofort den Arzt aufsuchen.
Sind andere Organe betroffen können die Symptome teilweise ähnlichen Charakter, wie die oben erwähnten Synmptome unter Herz und Lunge aufweisen, sind aber nich lebensbedrohlich.
Speiseröhre
Säure-Reflux, Verkrampfungen der Speiseröhre (Spasmen).
Brust- und Lungenfellerkrankungen
Muskulo-Skelettale Schmerzen
Blockierte Rippen, Rippenfraktur, blockierte Wirbel, Erkrankungen der Wirbelsäule
Bruxismus
Als Bruxismus wird das Zähneknirschen während dem Schlaf bezeichnet. Gemäss der Schweizerischen Zahnärztegesellschaft leidet jeder 10. Schweizer/-in unter ungewolltem Zähnknirschen während der Nacht. Vom Knirschen an sich bekommen die Betroffenen in der Regel nichts mit. Oft merken sie erst an den Folgen der nächtlichen Attacken, dass etwas nicht stimmt. Durch den enormen Druck können am Morgen Kopf und Kiefer schmerzen. Häufig zeigen sich die Nachwirkungen der nächtlichen Aktivitäten auch beim Zahnarztbesuch: Das Mahlen reibt die Kauflächen ab. Zudem können sich feine Linien im Schmelz bilden, sogenannte Schmelzrisse, und die Zahnhälse können überempfindlich werden.
Warum der Mensch mit den Zähnen knirscht, ist noch nicht im Detail geklärt. Es gilt jedoch als ziemlich sicher, dass Stress, Angststörungen, Depressionen, soziale Vereinsamung, aber auch veränderte Zahnstellungen oder Zahnformen zu den Auslösern gehören. Unklar ist bislang, ob auch genetische Faktoren eine Rolle spielen, es fällt eine gewisse familiäre Häufigkeit auf.
Solange es nicht zu stark wird, ist das Pressen und Knirschen nicht grundsätzlich schädlich. Manche Menschen brauchen das Zähneknirschen als emotionales Entlastungsventil. Wird das Zähneknirschen aber so stark, dass nennenswert Zahnhartsubstanz verlorengeht, Schmerzen auftreten oder die Kieferbewegung sich verändert, ist eine Behandlung nötig.
Therapie:
Um den Verlust des Zahnschmelzes zu stoppen, erhält der Patient für seine Zähne eine durchsichtige Schiene aus Kunststoff. Ziel des Aufbissbehelfs, häufig auch als Aufbissschiene bezeichnet, ist es, Ober- und Unterkiefer auseinanderzubringen und dadurch vom Knirschen abzuhalten. Man nutzt hier einen Schutzreflex aus der Frühzeit des Menschen aus. Der tritt zum Beispiel auch auf, wenn man auf einen Kirschstein beißen würde.
Weitere therapeutische Massnahmen:
Physiotherapie mit progressiver Muskelentspannung, Biofeedback, Botulinumtoxin und Psychotherapie können in speziellen Situationen helfen.
Chronisch-obstruktive Lungenerkrankung (COPD)
Entzündliche Krankheit der Lungen, die zu Atemnot führt und anders als Asthma bronchiale nicht rückgängig (reversibel) zu machen ist. Die Abkürzung bezieht sich auf die englische Bezeichnung chronic obstructive pulmonary disease, das soviel heißt wie «Krankheit der chronisch verengten Lungen». Rauchen ist die Hauptursache, weshalb die Krankheit in der Umgangssprache als Raucherhusten oder Raucherlunge bekannt ist. In den Atemwegen tritt das Leiden als chronische Bronchitis in Erscheinung. In den Lungenbläschen (Alveolen) zerstört die Entzündung das Lungengewebe, wodurch die kleinen Bläschen zu immer größeren zusammenfallen (Emphysem). Die Atmung kann bei COPD somit aus drei Gründen erschwert sein: Erstens, ähnlich wie beim Asthma, durch größeren Widerstand des Luftstroms in den verengten Luftwegen; zweitens wegen der verminderten Durchlüftung der teilweise zerstörten Lunge; drittens wegen der verminderten Gesamtfläche für den Gasaustausch zwischen Blut und Luft. Die Zahl der Erkrankten nimmt weltweit stark zu: COPD gehört weltweit zu den fünf häufigsten, in Europa sogar zu den drei häufigsten Todesursachen.
Symptome:
Das wichtigste Symptom von COPD ist die Kurzatmigkeit, die sich bis zur akuten Atemnot steigern kann. Vor allem das Ausatmen ist beschwerlich, weil die Patienten die Luft gegen den erhöhten Widerstand auszuatmen versuchen. Dies verengt die Atemwege noch stärker. Typisch für COPD ist deshalb ein relativ kurzes, heftiges Einatmen, gefolgt von einem langen, gepressten Ausatmen. In den ersten Stadien der Krankheit zeigt sich das bei körperlicher An- strengung. In fortgeschrittenen Stadien kommen die Patienten schon bei leichten Verrichtungen des Alltags außer Atem. Typisch für COPD sind auch ständiger Husten und Auswurf von Schleim (Sputum), Keuchen, ein Gefühl von Enge in der Brust und dauernde Müdigkeit.
Blaue Lippen (Zyanose) deuten auf Mangel an Sauerstoff hin; Hypoxämie. In späten Stadien treten Herzprobleme und geschwollene Arme und Beine auf.
Ursachen:
Die wichtigsten Ursachen für COPD sind das aktive Rauchen, das Ex-Rauchen und das Passivrauchen. Etwa neunzig Prozent der Fälle gehen auf die Belastung der Lungen durch Tabakrauch zurück. Die restlichen zehn Prozent verteilen sich auf Luftverschmutzung am Arbeitsplatz oder durch den Straßenverkehr. Asthma erhöht das Risiko für COPD etwa um das Zehnfache. Auch genetische Ursachen spielen eine Rolle; sie bestimmen mit, wie anfällig die Lungen für Schadstoffe sind.
Diagnose:
Bei Verdacht auf COPD misst der Arzt das forcierte Ausatmungsvolumen mit einer Spirometrie. Die Menge Luft, die der Patient in einer Sekunde ausatmen kann (Erstsekundenkapazität) gibt Aufschluss über die Schwere des Leidens. Aufnahmen der Lungen mittels Röntgen, und Computertomografie helfen bei der Diagnose. Sie sind des Weiteren ein wichtiges Mittel, um COPD von anderen Lungenleiden zu unterscheiden. Die Diffusionskapazität (Fähigkeit der Lunge zur Sauerstoffaufnahme) misst als Mass der Sauerstoffaufnahme die CO-Aufnahme durch die Alveolen. Die arterielle Blutgasanalyse zeigt, wie viel Sauerstoff und Kohlendioxid im Blut enthalten sind. Niedrige Werte von Sauerstoff (Hypoxämie) und hohe Werte von Kohlendioxid (Hyperkapnie) zeigen eine schlechte Leistung der Lungen an.
Behandlung:
Bei Weitem das Wichtigste ist, so schnell wie möglich mit dem Rauchen aufzuhören. Ohne diese Maßnahme nützen alle anderen nichts – die Krankheit verschlimmert sich immer weiter und führt schnell zu einer kontinuierlichen Verengung der Atemwege und zum Lungenemphysem. Medikamente wie Bronchodilatatoren können die Symptome von COPD lindern und die Atmung erleichtern. Sie erweitern die Atemwege oder hemmen die Entzündung der Schleimhäute. Bei fortgeschrittener COPD benötigen die Patienten eine Dauer-Sauerstofftherapie. Heimgeräte (Sauerstoffkonzentratoren) bereiten Sauerstoff aus der Raumluft auf, mobile Sauerstoffkonzentratoren (zT. nur 1.5kg schwer) ermöglichen eine adäquate Sauerstoffzufuhr bei körperlichen Aktivitäten. Die Patienten atmen ihn über einen langen Schlauch und Nasenbrille ein. So können sie sich in ihrer Wohnung bewegen, wenn auch eingeschränkt. Es gibt auch tragbare Geräte, die man mitnehmen kann, wenn man außer Haus geht. Chirurgische oder bronchoskopische Lungenvolumenreduktion kann bei einem Emphysem die Durchlüftung der gesunden Lungenbereiche verbessern und erleichtert somit die Atmung. Als letzte Maßnahme kommt in Ausnahmefällen eine Lungentransplantation in Betracht.
**Pulmonale Rehabilitation
Wer an COPD leidet, sollte sich regelmäßig gegen Grippe und Pneumokokken (Prevenar einmalig, Pneumovax alle 5-6 Jahre) impfen lassen, da jede Infektion den Lungen weiter schadet. Gezieltes Training der Atemmuskeln kann helfen, die Leistung der Lungen teilweise wieder zu steigern. Auch Kraft- und Ausdauertraining haben sich als wirksam erwiesen: Sie verbessern die Lebensqualität ebenso wie die Lebenserwartung.
Chronische Bronchitis
WHO Definition:
Husten und Auswurf an den meisten Tagen während mindestens je drei Monaten in zwei aufeinander folgenden Jahren (Definition der WHO, 1966).
Ursache:
Ist in den meisten Fällen das Rauchen (90%), seltener die Wirkung von Schadstoffen am Arbeitsplatz oder von Abgasen in der Umwelt. Daher auch Raucherhusten genannt. Die Bronchialschleimhaut reagiert auf diese Reize, indem sie mehr Schleim produziert. Die empfindlichen Flimmerhärchen sterben ab, so dass sich mehr Schleim in den Bronchien ansammelt, was den Hustenreiz auslöst. Im liegengebliebenen Schleim können sich Bakterien besser einnisten, was Infektionen begünstigt. Falls diese andauern, zerstören sie mit der Zeit das Lungengewebe; es entwickelt sich eine chronisch-obstruktive Lungenkrankheit (COPD).
Therapie:
Sofortiger, strikter Rauchstopp, Schutz vor dem Passivrauchen, Schleim lösende Medikamente (Expektorantien) einnehmen; Antibiotika, Atemtherapie, Klopf- massage, Bronchodilatatoren, Kortison; bei schwerer Atemnot (COPD) Sauerstofftherapie langfristig.
Chronische granulomatöse Erkrankung
Definition:
Die chronische Granulomatose (CGD) ist eine genetisch bedingte (vererbte) Krankheit. Sie kennzeichnet sich durch die Unfähigkeit der phagozytischen Zellen im Körper (auch Phagozyten genannt), Wasserstoffperoxid und andere Oxidantien zu erzeugen, die zur Abtötung bestimmter Mikroorganismen erforderlich sind. Aufgrund dieses Abtötungsdefekts der Phagozyten sind Patienten mit CGD anfälliger für Infektionen, die durch bestimmte Bakterien und Pilze verursacht werden. Darüber hinaus häufen sich bei dieser Krankheit an den Stellen der Infektion oder anderer Entzündungen verstärkt Immunzellen zu Komplexen an, die als “Granulome” bezeichnet werden (daher der Name der Krankheit).
Diagnose:
Da die häufigste genetische Kategorie der CGD nur bei Jungen auftritt, kann es zu dem Missverständnis kommen, dass Mädchen nicht an CGD erkranken können. Es gibt jedoch mehrere genetische Kategorien von CGD, und einige davon können auch bei Mädchen auftreten. So sind rund 15% aller CGD- Patienten Mädchen.
Die CGD kann unterschiedlich schwere Ausmaße annehmen, und teilweise entscheidet der Zufall, wann ein Patient mit CGD eine schwerwiegende Infektion entwickelt. Aus diesem Grund weisen manche CGD-Patienten bis zum späten Jugendalter oder sogar bis zum Erwachsenenalter keine Infektion auf, die auf das Vorliegen dieser Krankheit aufmerksam macht.
Behandlung:
Ein wesentliches Element der Therapie ist die frühe Diagnose einer Infektion sowie die sofortige Durchführung einer aggressiven Behandlung mit geeigneten Antibiotika und antifugalen Medikamenten (gegen Pilze).
Chronische thromboembolische Erkrankung
Diese Erkrankungen entstehen durch eine erhöhte Bereitschaft zur Blutgerinnung im venösen Teil des Kreislaufsystems. Die Bildung von Blutgerinnseln wird durch tiefe und oberflächliche venöse Thrombosen (z.B. Bein-und Beckenvenenthrombosen) sowie Lungenembolien begünstigt.
Die Ursachen für die ineffektive endogene Fibrinolyse sind in den meisten Fällen unklar. Klassische Risikofaktoren für die Entwicklung einer chronischthromboembolischen Erkrankung sind Thrombophilie, Zustand nach Splenektomie, ventrikulo-atriale Shunts, intrakardiale Schrittmachersonden, myelodysplastische Syndrome, chronisch-entzündliche Darmerkranungen und angeborene Gerinnungsstörungen (Leiden-Faktor-V-Mutation, Protein S- und C-Mangel, andere Koagulopathien).
Lunge:
In der Lunge kann sich chronische thromboembolische pulmonale Hypertonie (CTEPH) entwickeln.
Lösen sich die Emboli (losgelöste Thrombosen zB. aus den Beinen -> Beinvenenthrombosen) nicht vollständig auf und bleiben in den Lungenarterien stecken (-> Lungenembolien), wandeln sie sich in fibrotisches Narbengewebe um, so dass sie sich unter Antikoagulation (Blutverdünnung) nicht mehr zurückbilden. Aus dem erhöhten pulmonal-vaskulären Widerstand resultiert eine pulmonale Hypertonie (erhöhter Lungendruck), die ihrerseits im weiteren Verlauf zu mikrovaskulären Läsionen und Gefäßremodelling in den nichtokkludierten Abschnitten der Lungenstrombahn führt. Auch wenn es nicht zu weiteren thromboembolischen Ereignissen kommt, ist die CTEPH aus diesem Grund eine progredient verlaufende Erkrankung. Im späten Krankheitsstadium entwickelt sich eine Rechtsherzinsuffizienz, die zu einer ernsthaften irreversiblen Erkrankung des Herzens führen kann.
Diagnose:
CTEPH nachzuweisen beziehungsweise auszuschließen ist essenzieller Bestandteil der diagnostischen Abklärung jeder ätiologisch unklaren pulmonalen Hypertonie (Lungendruckerhöhung). Einzelne oder rezidivierende venöse Thromboembolien in der Vorgeschichte machen die Diagnose wahrscheinlich, aber auch bei Patienten ohne entsprechende Anamnese ist die Abklärung einer CTEPH unabdingbar. Wichtigste diagnostische Maßnahme ist die Ventilations-Perfusionsszintigraphie beziehungsweise bei Patienten mit normalem Röntgenbefund die alleinige Perfusionsszintigraphie. Sie besitzt selbst im Zeitalter der hochauflösenden Computertomographie (CT) die höchste Sensitivität für diese Erkrankung. Der negative prädiktive Wert liegt bei nahezu 100 %, das heißt, eine regelrechte Perfusionsverteilung schließt eine CTEPH mit an Sicherheit grenzender Wahrscheinlichkeit aus. Allerdings ist der Nachweis von Perfusionsdefekten nicht spezifisch für eine CTEPH, da ähnliche Befunde gelegentlich auch bei anderen Formen der pulmonalen Hypertonie oder Vaskulitiden sowie malignen Erkrankungen der Pulmonalgefäße, wie zum Beispiel Sarkomen (bösartige Geschwulst der Lungengefässe), gefunden werden können.
Die CT-Angiographie kann ebenfalls wichtige Hinweise auf eine CTEPH liefern. Dazu gehören neben dem direkten Nachweis entsprechender Läsionen in den Pulmonalarterien sowie proximaler Wandveränderungen auch indirekte Zeichen. Zu diesen zählen vor allem kräftige Bronchialarterien und die sogenannte Mosaikperfusion, die aus scharf abgegrenzten, nebeneinander liegenden hyper- und hypoperfundierten Arealen besteht. Entscheidend ist aber, dass ein als unauffällig befundetes Angio-CT des Thorax nicht mit Sicherheit ausschließt, ob eine CTEPH vorliegt.
Therapie:
Orale Antikoagulation, pulmonale Endarterektomie, gezielte medikamentöse Therapie, supportive Massnahmen (O2-Therapie).
Chronischer Husten
Definition:
Beim chronischem Husten handelt es sich um eine Symptom einer Ursache, die seit mehr als 6-8 Wochen besteht.
Häufigste Ursachen:
Asthma bronchiale
Chronische Bronchitis
Bronchiektasen
Chronisch obstruktive Lungenerkrankung
Husten nach einer Lungenentzündung (postinfektiöse Hyperreagibilität)
Keuchhusten (Pertussis)
Tuberkulose
Pleuraerguss
Lungenfibrose
Pneumokoniosen
Exogen allergische Alveolitis
Entzündung der Nasennebenhöhlen (chronische Sinusitis)
Gastroösophagealer Reflux
Nebenwirkung von Medikamente (ACE-Hemmern, Beta-Blocker und Nitrofurantoin)
Herzschwäche
Lungenkrebs (vor allem bei Rauchern/-innen über 45 Jahren ist an diese Erkrankung zu denken)
Wenden Sie sich an Ihren Lungenarzt zur weiteren Abklärung!
Erkrankung der Pulmonalklappe
Wenn das Blut vom Körper zurück in den rechten Vorhof des Herzens fliesst, dann in die rechte Herzkammer, tritt das Blut durch die Pulmonalklappe in die Lungenarterie ein und von dort in die Lungen.
Die Pulmonalklappe ist nur selten bei erwachsenen Patienten erkrankt. Einige wenige Patienten können im Erwachsenenalter eine degenerative Pulmonalklappenerkrankung entwickeln, bei der es entweder zu einer Verengung (Pulmonalklappenstenose) oder Undichtigkeit (Pulmonalklappeninsuffizienz) kommen kann. Häufiger ist eine Pulmonalklappenerkankung bei Erwachsenen dann zu finden, wenn bereits in der Kindheit eine Pulmonalklappenerkrankung bestand und diese z.B. mit einem chirurgischen Klappenersatz behandelt wurde. In solchen Fällen, kann die in der Kindheit behandelte Klappe später erneut eine Behandlung bedürfen.
Bei Erwachsenen mit einer behandlungsbedürftigen Pulmonalklappenerkrankung kann in geeigneten Fällen ohne Operation durch einen Herzkathetereingriff eine neue Klappenprothese implantiert werden. Dabei wird z.B. eine ähnliche Klappe, wie sie für die Aortenklappenstenose eingesetzt wird (TAVI Klappe) über die Leistenvene in das rechte Herz eingebracht und durch einen Ballon implantiert.
Fortgeschrittenes Schlafphasen-Störungs-Syndrom (ASPD)
Die fortgeschrittene Schlafphasen-Störung (advance sleep phase disorder, ASPD) ist eine von mehreren zirkadianen Schlafrhytmusstörungen.Diese Störungen treten bei Personen auf, welche zu Zeiten ungewöhnlichen Zeiten ihrem Schlafbedürfnis nachgehen. Betroffene schlafen Stunden bevor der normalen Bettzeiten, es resultiert ein Erwachen Stunden bevor die meisten anderen Leute erwachen.
Betroffene mit ASPD fühlen sich bereits am Nachmittag schläfrig, sie gehen meist bereits zwischen 18:00-21:00 Uhr zu Bett. Als Konsquenz aus der frühen Bettzeit erwachen sie meist bereits zwischen 2:00-5:00 Uhr. Wegen der frühen Bettzeit, bei normaler Schlafdauer, resultiert ein zu frühes Erwachen. Der Schlaf per se ist normal.
Alle zirkadianen Schlafstörungen zeigen eine frühe Ausschüttung von schlafinduzierenden Substanzen, wie Melatonin und andere Hormone. Auch die Körpertemperatur-Veränderungen treten viel früher auf, weshalb die Aufzeichnung der Körpertemperatur diagnostische Hinweise liefern kann.
Einigen Betroffenen, va. jüngeren Leuten gelingt es diesem frühen Tagesplan zu folgen, oft kommt es aber in den frühen Abendstunden zu erheblichen Schwierigkeiten wach zu bleiben. Durchbricht man bewusst die Abendmüdigkeit führt dies zu Schlafentzug und zunehmender Tagesmüdigkeit, es resultiuert eine übermässige Schläfrigkeit. Sogar unter Schlafentzug neigen Betroffene mit ASPD, weiterhin früh zu erwachen.
Betroffene mit ASPD neigen häufig zu einer Fehlinterpretation ihres Schlafproblems. Es wird als Insomnie oder Depression fehl gedeutet.
Betroffene mit ASPD sind geeignet für frühe Arbeitsschichten, versuchen oft aber durch Stimulationen (Kaffee, Amphetamine, etc.) länger wach zu beleiben, können dann aber nicht einschlafen und beginnen abendlichen Alkoholkonsum oder Schlaftabletten zu nehmen.
Unser Zentrum für Schlafmedizin ist spezialisiert zur Abklärung, Beratung und Therapieeinleitung von zirkadianen Schlafstörungen.
Granulomatose mit Polyangiitis
Die Granulomatose mit Polyangiitis, abgekürzt GPA, gehört zu den entzündlich-rheumatischen Erkrankungen. Früher hieß die Erkrankung Wegener Granulomatose.
Das Immunsystem der Betroffenen greift – sozusagen “versehentlich” – Bestandteile bestimmter weißer Blutzellen an, es werden Antikörper gegen die eigenen Zellen prodiziert, eine sog. Autoimmunerkrankung. Die Folge ist eine Gefäßentzündung mit Zerstörung der Gefäßstruktur, eine nekrotisierende Vaskulitis.
Außerdem bilden sich entzündliche Zellhaufen, sogenannte Granulome, vor allem an den oberen und unteren Atemwegen. Die Erkrankung kann letztlich alle Organe befallen. Typisch ist auch eine bestimmte Form der Nierenentzündung (Glomerulonephritis).
Häufigkeit:
Meist zeigt sie sich aber zwischen dem 50. und 60. Lebensjahr. Männer und Frauen sind gleichermaßen betroffen. Jedes Jahr erkranken acht bis zehn von einer Million Menschen neu an GPA. Knapp 100 Menschen pro einer Million leiden an einer GPA.
Ursachen:
Die Ursachen der Krankheit sind nicht geklärt. Neue Untersuchungen haben gezeigt, dass es genetische Marker gibt, die in Kombination mit bestimmten bakteriellen Infektionen (durch Staphylokokkus aureus) wahrscheinlich eine GPA auslösen können.
Symptome:
Zu Beginn der Erkrankung ist eine GPA auf die oberen und unteren Atemwege beschränkt (lokalisiertes Stadium). Sie ähnelt meistens hartnäckigen Infektionen in Bereich der oberen Atemwege. Typisch ist ein blutig-krustiger Schnupfen. Mit der Zeit kann der Entzündungsprozess die Nasenscheidewand zerstören und zu einer sattelartigen Verformung des Nasenrückens führen. Auch Geschwüre der Mundschleimhaut und chronische Entzündungen des Mittelohres und der Nasennebenhöhlen sind häufig. Sind Kehlkopf, Luftröhre und Bronchien betroffen, droht insbesondere im Kindesalter eine kritische Einengung der Atemwege mit Atemnot und Erstickungsgefahr. Auch die Lunge kann beteiligt sein, was als Rundherde im Röntgenbild sichtbar ist.
An das lokalisierte Stadium schließt sich meist ein generalisiertes Stadium an. Es können grundsätzlich alle Gewebe und Organe befallen sein. Es kommt zu entzündeten (roten) Augen, zu Schmerzen von Gelenken und Muskeln und zu Funktionsstörungen von Nerven mit Taubheit und Missempfindungen. Am häufigsten ist die Niere betroffen, und zwar in Form einer rasch fortschreitenden Entzündung der Nierenkörperchen (Glomerulonephritis) bis hin zum Nierenversagen. Meist tritt das kombiniert mit einer schweren Entzündung der kleinen Blutgefäße der Lunge auf (pulmo-renales Syndrom). Oft kommen Allgemeinsymptome wie Abgeschlagenheit, Fieber, Nachtschweiß, Appetitlosigkeit und Gewichtsverlust vor.
Diagnose:
Meist findet der Arzt bei einer Blutuntersuchung Zeichen für eine Entzündung (zum Beispiel eine erhöhte Blutsenkungsgeschwindigkeit, hohes Entzündungseiweiß, vermehrt weiße Blutkörperchen) sowie eine Verminderung der roten Blutkörperchen. Spezifischer ist der Nachweis bestimmter Autoantikörper: cANCA oder PR3-ANCA.
Gewebeproben aus den Nasen-Rachen-Bereich, der Lunge und der Niere ergeben bei einer Granulomatose mit Polyangiitis das typische feingewebliche Bild einer granulomatösen Entzündung in den arteriellen Gefäßwänden oder um sie herum.
Eine Glomerulonephritis zeigt neben auffälligen Nierenwerten auch bestimmte Veränderungen in einer Unrinprobe (sogenannte Erythrozytenzylinder im Urinsediment).
Daneben können Gefäßveränderungen und Granulome auch in Röntgenaufnahmen und Kernspin-Untersuchungen erkennbar sein.
Als bewiesen gilt eine Granulomatose mit Polyangiitis dann, wenn mindestens zwei der vier folgenden Kriterien erfüllt sind:
(1) Entzündungen in Nase und Mund mit Geschwüren und eitrigem Ausfluss aus der Nase
(2) Rundherde im Röntgenbild der Lunge
(3) typische Veränderungen in der Urinprobe
(4) typisches Bild in einer feingeweblichen Untersuchung (Biopsie).
Therapie:
Eine GPA wird mit Medikamenten behandelt, die das überschießend arbeitende Immunsystem bremsen. Dazu gehören unter anderem Wirkstoffe wie Kortison, Methotrexat und Cyclophosphamid. Abhängig vom Stadium und der Schwere der Erkrankung wählt der Arzt eine Wirkstoffkombination aus. Seit 2013 ist für die schwere GPA Rituximab zugelassen worden, ein sogenanntes Biologicum, das gezielt bestimmte, wesentlich an der Entzündung beteiligte Immunzellen (B-Lymphozyten) neutralisiert.
Im Anschluss an eine erste Therapiephase (primäre Therapie, Induktionstherapie) folgt eine Erhaltungstherapie (zum Beispiel Methotrexat, Azathioprin). Unter der Behandlung ist eine regelmäßige Kontrolle der Leberwerte und des Blutbildes notwendig. Durch die Medikamente besteht eine erhöhte Anfälligkeit für Infekte. Ein Infektionsschutz durch bestimmte Impfungen (zum Beispiel gegen Grippe oder Pneumokokken) wird daher empfohlen.
Ohne Behandlung ist die Prognose einer GPA sehr ernst. Mit einer optimalen Therapie erzielt man heute sehr oft gute Erfolge. Schäden an Organen, vor allem ein Nierenversagen, wirken sich ungünstig aus.
Bei der Mehrzahl der Betroffenen treten Erkrankungsrückfälle auf. Daher ist es wichtig, die Betroffenen auf Frühzeichen eines solchen Rückfalles zu schulen, damit sie ihn rechtzeitig erkennen und sich behandeln lassen können.
Die Ärzte des LungenZentrums haben grosse Erfahrung in der Behandlung dieser Krankheit, welche in enger Zusammenarbeit mit anderen Spezialisten an der Klinik Hirslanden erfolgt.
Hepatopulmonales Syndrom
Fortgeschrittene akute oder chronische Lebererkrankungen gehen häufig mit funktionellen Abnormitäten des Lungenkreislaufs einher,
die sich in einer intrapulmonalen Gefäßdilatation (Erweiterung der Lungengefässe) manifestieren und zur arteriellen Hypoxämie (Sauerstoffarmut im gesättigten Blut) führen. Diese Störung wird als hepatopulmonales Syndrom (HPS) bezeichnet. Hierbei bestehen die pulmonalvaskulären Veränderungen hauptsächlich in dilatierten präkapillären und kapillären Gefäßen und direkten arteriovenösen Verbindungen. Dies führt zur Ausbildung von funktionellen intrapulmonalen Rechts-Links-Shunts, einem Ventilations-Perfusions-Missverhältnis und einer Einschränkung der Diffusion, somit letztlich zur arteriellen Hypoxämie. Das hepatopulmonale Syndrom tritt bei 5 bis 29 Prozent der Patienten mit fortgeschrittenen Lebererkrankungen auf. Die Mortalität (Sterberate) ist mit 41 Prozent über drei Jahre unabhängig von der Leberfunktion sehr hoch, einzig wirksame Therapie ist – neben der symptomatischen Sauerstoffgabe – die Lebertransplantation.
Hypersensitivitäts-Pneumonitis (EAA)
Definition:
Die exogen allergische Alveolitis (EAA), auch Hypersensitivitätspneumonitis genannt, stellt eine heterogene Gruppe von immunologisch vermittelten, diffusen Lungenparenchymerkrankungen dar, welche durch wiederholte Inhalation von Mikroorganismen, tierischen Proteinen oder chemischen Stoffen hervorgerufen werden. Neuere Untersuchungen weisen darauf hin, dass das Krankheitsbild aus einer durch genetische und Umgebungsfaktoren modifizierten Interaktion zwischen Immunsystem des Exponierten und inhalierten Antigenen resultiert.
Diagnose:
Der Schlüssel zur Diagnose ist meistens eine minutiöse Anamnese. Ein normales konventionelles Thoraxröntgenbild ist zum Aus- schluss einer EAA ungenügend, so dass im Verdachtsfall in erster Linie eine hochauflösende Thorax-CT und eine Bronchoskopie mit bronchoalveolärer Lavage und transbronchialen Lungenbiopsien veranlasst werden sollten.
Therapie:
Wichtigste therapeutische Massnahme bleibt der Antigenexpositionsschutz, während systemische Kortikosteroide nur in schweren Fällen zum Einsatz kommen. Neue antiinflammatorische, immunoregulatorische und antifibrotisch wirksame Substanzen sind vielversprechende Therapiealternativen für die EAA und andere interstitielle Lungenerkrankungen. Die exogen allergische Alveolitis (EAA), auch Hypersensitivitätspneumonitis genannt, stellt eine heterogene Gruppe von immunologisch vermittelten, diffusen Lungenparenchymerkrankungen dar, welche durch wiederholte Inhalation von Mikroorganismen, tierischen Proteinen oder chemischen Stoffen hervorgerufen werden.
Idiopathische Hypersomnie
Definition:
Die Idiopathische Hypersomnie ist eine Schlafstörung, die in zwei Formen auftritt, als Idiopathische Hypersomnie mit langer Schlafzeit und Idiopathische Hypersomnie ohne lange Schlafzeit. Bisherige, unsichere Schätzungen der Prävalenz ergaben 1:10.000 bis 1:25.000 für die erste Form und 1:11.000 bis 1:100.000 für die zweite. Beide Formen beginnen vor dem 25. Lebensjahr. Beide Geschlechter sind gleich häufig betroffen. Die Idiopathische Hypersomnie mit langer Schlafzeit ist gekennzeichnet durch verlängerten (mehr als 10 Stunden dauernden) Nachtschlaf von guter Qualität, durch mehr oder weniger konstante exzessive Schläfrigkeit am Tag mit verlängerten, nicht erfrischenden Schlafepisoden und durch die Schwierigkeit aufzuwachen, mit Schlaftrunkenheit und Morgensteife. Die Idiopathische Hypersomnie ohne lange Schlafzeit ist gekennzeichnet durch mehr als 3 Monate anhaltende exzessive Tag-Schläfrigkeit mit unvermeidbaren und mehr oder weniger erfrischenden Nickerchen. Der Nachtschlaf ist normal oder geringfügig, aber nicht über 10 Stunden, verlängert und die Qualität des Aufwachens ist oft normal. Die Idiopathische Hypersomnie ist niemals mit Kataplexie verbunden. Die Ursache ist nicht bekannt. Es besteht keine Assoziation mit HLA-Merkmalen, und die Orexin/Hypocretin-Spiegel sind normal.
Diagnose:
Die Diagnosestellung ist komplex, da die vermehrte Schlafdauer als solche erkannt und andere Ursachen von Schläfrigkeit ausgeschlossen werden müssen. Grundlage der definitiven Diagnose ist die Polysomnographie, ergänzt durch multiple Schlaflatenztests (MSLT). Die Tests ergeben eine gute Schlafqualität, eine mittlere Schlaflatenz von unter 8 Minuten und höchstens 1 Episode paradoxen Schlafes. Bei Idiopathischer Hypersomnie mit langer Schlafzeit wird eine kontinuierliche 24- bis 36-stündige Ableitung durchgeführt, wenn der MSLT einen mehr als 10-stündigen Nachtschlaf und am Tag Nickerchen von mehr als 1 Stunde Dauer ergibt. Durch klinische Analyse (im wesentlichen mittels Führen eines Schlaftagebuches und Aktimetrie) wird das Syndrom chronisch ungenügenden Schlafes ausgeschlossen. Durch Schlaf-Ableitungen werden Narkolepsie, Rhythmusstörungen und fragmentierter Nachtschlaf durch motorische oder respiratorische Ereignisse ausgeschlossen. Hypersomnie psychiatrischen Ursprungs wird durch psychologische Untersuchung ausgeschlossen. Zum Ausschluss zerebraler Läsionen werden gelegentlich auch neuro-radiologische Untersuchungen durchgeführt.
Therapie:
Die Behandlung besteht in der Gabe von Stimulanzien. Wegen des im Vergleich zu Methylphenidat und Amphetaminen besseren Nutzen/Risiko-Verhältnisses wird in erster Linie Modafinil gegeben. Diese Medikamente mindern die Schläfrigkeit am Tag und haben wenig Wirkung auf die Schlaftrunkenheit bei Idiopathischer Hypersomnie mit langer Schlafzeit. Die Krankheit hat negative Auswirkungen auf das soziale und berufliche Leben. Der Krankheitsverlauf ist im Schweregrad stabil, über einige Fälle von spontaner Besserung wurde berichtet.
Unsere Spezialisten im Zentrum für Schlafmedizin sind für die Diagnosestellung und Beratung zuständig.
In Entwicklung
In Entwicklung
In Entwicklung
In Entwicklung
Insomnie
Einschlaf- und Durchschlafstörungen kommen durch alltägliche Belastungssituationen auch bei Gesunden vor. Entscheidend für den Arzt ist es daher, schwer erkrankte und damit behandlungsbedürftige Insomniepatienten zu identifizieren.Arzt und Patient erkennen eine behandlungsbedürftige Insomnie daran, daß die Beschwerden die vier Diagnosekriterien für Insomnie der Weltgesundheitsorganisation WHO erfüllen.
Diagnosekriterien der WHO für Insomnie:
Der Patient klagt über Einschlafstörungen oder eine schlechte Schlafqualität.
Die Schlafstörungen treten wenigstens 3 mal pro Woche und mindestens einen Monat lang auf.
Es besteht ein überwiegendes Beschäftgtsein des Patienten mit der Schlafstörung nachts und während des Tages eine übertriebene Sorge über deren negative Konsequenzen.
Die unbefriedigende Schlafdauer und/oder Schlafqualität verursacht entweder einen deutlichen Leidensdruck oder wirkt sich störend auf die soziale und berufliche Leistungsfähigkeit aus.
Ursachen von chronischen Ein- und Durchschlafstörungen:
psychiatrisch bedingte Schlafstörung (3-36%)
primär-psychophysiologische Schlafstörung (15-24%)
Schlafstörung bei ruhelosen Beinen, periodischen Beinbewegungen oder Atmungsregulationsstörungen (18-25 %)
substanzinduzierte Schlafstörung (z.B. Alkohol, Medikamente) (7-12%)
andere organisch bedingte Schlafstörüngen (4-11%)
Schlafstörungen anderer Ursache (7-15%)
Die Insomnie ist eine dr häufigsten Diagnosen in unserem Zentrum für Schlafmedizin, unsere Spezialisten helfen bei der Diagnosestellung und Therapieeinleitung.
Interstitielle Lungenerkrankung (ILD)
Als interstitielle Lungenerkrankung wird eine meist chronisch verlaufende Entzündungen des Lungeninterstitiums bezeichnet, des Raums zwischen den Lungenbläschen also, in dem Bindegewebefasern, Nerven und Blutgefäße liegen. Dieser gesamte Komplex stellt das Lungengerüst dar.
Es gibt über 100 verschiedene Krankheiten des Lungeninterstitiums, deren Ursachen nur zum Teil bekannt sind.
Ursachen:
Die Ursachen für ILDs sind mannigfaltig und werden in bekannte und unbekannte Ursachen unterschieden. Durch eine zunehmende Vernarbung der Lunge entsteht in manchen Fällen eine Lungenfibrose. Bekannte Ursachen sind zum Beispiel Auswirkungen von Medikamenten auf die Lunge (z.B. Amiodaron oder MTX) oder die Mitbeteiligung der Lunge durch eine rheumatische Erkrankung, die sog. Kollagenosen, wie z.B. Rheuma oder die systemische Sklerodermie (SSc). Daneben gibt es sog. granulomatöse ILDs, wie z.B. die Sarkoidose oder die exogen allergische Alveolitis. Letztere ist eine allergische Überreaktion der Lunge durch eingeatmete Stäube – eine oft bekannte Unterart ist z.B. die sog. Vogelhalterlunge. Eine weitere Gruppe der ILD umfasst seltene interstitielle Lungenerkrankungen wie eine Lymphangioleiomyomatose (LAM), eine pulmonale Alveolarproteinose oder eine eosinophile Pneumonie. Von diesen Erkrankungen trennt man eine weitere Gruppe ab – die der idiopathischen interstitiellen „Pneumonien“. Dies sind Lungenerkrankungen unklarer Ursache, bei denen es zu typischen radiologischen und histologischen Veränderungen kommt. Die häufigste ist die idiopathische Lungenfibrose (IPF), eine chronische Lungenerkrankung, bei der in der letzten Zeit viele Fortschritte zu verzeichnen waren. Gemeinsam ist allen interstitiellen Lungenerkrankungen, dass sie zumeist typische klinische, bildgebende und pathologische Veränderungen haben.
Symptome:
Die Beschwerden sind am Anfang oft vollkommen unspezifisch. Husten und Luftnot bei Belastung sind die ersten Symptome. In der Regel vergehen so viele Monate, bis die Diagnose einer interstitiellen Lungenerkrankung gestellt wird.
Die meisten Betroffenen sind durch die große Anzahl der Fachbegriffe und die vielen verschiedenen Ursachen dieser Erkrankungen verunsichert. Da es sich um sehr komplexe Krankheitsbilder handelt, ist die Diagnostik und Behandlung schwierig und macht ein umfangreiches und interdisziplinäres Expertenwissen notwendig. Interdisziplinär bedeutet, dass diese Erkrankungen gemeinsam durch mehrere Fachdisziplinen – insbesondere Innere Medizin / Pneumologie, Radiologie und Pathologie – diagnostiziert werden und die Ergebnisse dann gemeinsam diskutiert werden.
Diagnose:
Die Diagnostik umfasst in der Regel eine ausführliche Anamnese, d.h. Fragen zur Erkrankung. Zudem verschiedene Lungenfunktions- und Bluttests, radiologische und bronchoskopische Untersuchungen (BAL - bronchoalveoläre Lavage, TBB - transbronchiale Biopsie, Wedge-Resektion - thrakoskopische Biopsie).
Therapie:
Die Therapie ist je nach Form der Lungenerkrankung unterschiedlich und muss in Absprache mit dem Patienten erfolgen. Die Behandlungsmöglichkeiten unterscheiden sich sehr nach der Art der Erkrankung und deren Prognose. Nur im ausführlichen Gespräch mit dem Patienten kann über die Notwendigkeit und Art einer Therapie gemeinsam entschieden werden.
Weitere wichtige Therapiebausteine sind die Behandlung bestimmter Begleiterkrankungen (sog. Komorbiditäten), regelmäßige Impfungen z.B. gegen Grippe (Influenza), bei Bedarf eine Langzeitsauerstofftherapie oder die Teilnahme an Lungensport und einer Rehabilitation. Auch ist gelegentlich eine rechtzeitige Beratung hinsichtlich einer Lungentransplantation erforderlich. In vielen Fällen bietet sich auch die Teilnahme an Studien an, bei denen moderne, innovative Therapien oder neue Untersuchungstechniken zum Einsatz kommen.
Bei der IPF (idiopathische interstitielle Lungenfibrose) gab es lange Zeit keine medikamentöse Therapie, mit der sich der Verlauf einer idiopathischen Lungenfibrose (IPF) nachweislich verzögern ließ. Seit einigen Jahren sind jedoch zwei spezielle Medikamente zu Behandlung von IPF zugelassen – Pirfenidon und Nintedanib.
Ihre Ärzte im LungenZentrum Hirslanden haben grosse Erfahrung im Einsatz dieser neuen Medikamente und helfen Ihnen die richtigen Therapieentscheide zu fällen.
Karzinoide der Lunge
Karzinoide (Karzinoidtumoren) sind seltene Tumoren, die aus hormonbildenden (endokrinen) Zellen hervorgehen und oftmals Hormone, Überträger- oder Botenstoffe produzieren. Typischerweise wachsen Karzinoidtumoren langsam und treten v.a. im Magen, Dünndarm, Dickdarm, Wurmfortsatz, Thymusdrüse (Bries) oder Lunge auf.
gut- oder bösartig?
Weder der Begriff des neuroendokrinen Tumors noch die Bezeichnung Karzinoid legen sich fest, ob der Patient an einem gutartigen oder an einem bösartigen Tumor erkrankt ist. Bei gut-differenzierten (Ki-67≤2%) neuroendokrinen Tumoren kann auch heutzutage der Pathologe bei der feingeweblichen Begutachtung des Tumors unter dem Mikroskop nicht immer sicher sagen, ob es sich um einen gutartigen oder einen bösartigen Tumor handelt. Oftmals ist es erst der klinische Verlauf, der es nach Monaten oder Jahren erlaubt sicher zu entscheiden, ob das Karzinoid sich gut- oder bösartig verhält. Sichere Belege für die Bösartigkeit (Malignität) von Karzinoidtumoren sind das Auftreten von Tochtergeschwulsten. Für Bösartigkeit spricht auch das Eindringen des Tumors in die tiefen Wandschichten, eine Mitbeteiligung der Gefäße (Angioinvasion) sowie der feingewebliche (histologische) Verlust einer guten Ausdifferenzierung.
Differenzierungsgrad entscheidet über Prognose
Als „Marker“ werden ins-besondere die Rate von Zellteilungen und der prozentuale Anteil von Tumorzellen verwendet, die sich positiv färben für den Proliferationsmarker Ki-67. Als G1 neuroendokrine Tumore werden gut-differenzierte Tumoren bezeichnet, die feingeweblich eine Proliferationsrate <2% bzw. eine Ki-67-Rate von ≤2% aufweisen. Patienten mit G1-differenzierten neuroendokrinen Tumoren haben im allgemeinen eine sehr gute Prognose. Tumoren mit einer Proliferationsrate zwischen 2 und 20% werden als G2 Tumore bezeichnet; auch G2-differenzierte neuroendokrine Tumore gelten heutzutage i.d.R. als gut-differenziert. Bei den Tumoren mit einer Proliferationsrate über 20% handelt es sich in der überwiegenden Mehrzahl um schlecht differenzierte oder gar undifferenzierte neuroendokrine Tumore, die i.d.R. mit einer weniger günstigen Prognose einhergehen. G3-differenzierte, neuroendokrine Tumoren werden nach der neuesten WHO-Klassifikation (von 2010) als neuroendokrine Karzinome bezeichnet.
Karzinoide der Lunge
Als Lungentumore sind die neuroendokrinen Tumore der Lunge oder bronchiale Karzinoide zwar selten, die Lunge ist jedoch die zweithäufigste Ursprung der neuroendokrinen Tumore nach dem Verdauungstrakt. Die neuroendokrinen Tumore der Lunge treten in bis zu 15% der Fälle im Rahmen von Keimbahnmutationen auf. Sie können jedoch auch ohne bekannte Keimbahnmutation familiär gehäuft auftreten.
Neuroenokrine Tumore der Lunge machen etwa 1 – 2% aller Lungentumoren im Erwachsenenalter aus. Bei Kindern zählen sie zu den häufigsten bösartigen Lungenerkrankungen. Sie präsentieren sich typischerweise erst im späten Jugendalter. In den meisten Untersuchungsserien sind Frauen häufiger betroffen als Männer. Die ansteigende Häufigkeit in den letzten Jahrzehnten ist weniger auf eine Zunahme der Häufigkeit zurückzuführen als auf die bessere bildgebende Diagnostik und feingewebliche Beurteilung. Das Durchschnittsalter, in dem die Diagnose bei neuroendokrine Tumorengestellt wird, liegt bei 45 Jahren. Eine Assoziation von neuroendokrinen Tumoren und Nikotinkonsum ist nicht bewiesen.
Die neuroendokrinen Tumoren können sich biologisch unterschiedlich verhalten. Ein eher gutartiges Verhalten zeigen die typischen Karzinoide während die atypischen Karzinoide schneller wachsen und häufiger Tochtergeschwülse bilden. Das großzellige neuroendokrine Karzinom gleicht biologisch dem kleinzelligen Bronchialkarzinom (SLCL) mit hochaggressivem Verhalten, schnellem Wachstum und früher Bildung von Tochtergeschwülsten.
1-2 % alle Lungentumoren
25% aller Karzinoide
80-90 % typische Karzinoide
10-20 % atypische Karzinoide
70-80 % proximal, 20-30 % peripher
61% liegen rechtsseitig, v.a. im Mittellappen
Diagnose
Labor:
Als Tumormarker können Chromogranin A und Neuronenspezifische Enolase verwendet werden.
Röntgendiagnostik:
75% der Patienten mit einem bronchialen Karzinoid haben ein suspektes Rö-Thorax. Die meisten Raumforderungen sind rund bis oval, 2 – 5cm im Durchschnitt und hilär bzw. perihilär gelegen. Eine Kavernenbildung ist selten.Die meisten neuroendokrinen Neoplasien stellen sich im CT dar, liegen oft in den Bronchien.
Bronchoskopie, Endosonographie und Biopsie:
Ungefähr ¾ der bronchialen Karzinoide können durch eine Spiegelung der Atemwege erkannt werden. Zudem kann auf diese Weise eine Probe feingeweblich untersucht werden. Allerdings kann es dadurch zu starken Blutungen kommen.
Octreotidszintigraphie:
Neuroendokrine Tumoren weisen zu 40% – 80% Somatostatinrezeptoren auf, die radioaktiv markierte Somatostatinanaloga (111Indium markiertes Octreo- oder Pentatreotid) binden und mittels Gamma-Kamera dargestellt werden können. Die Indium-Octreotidszintigraphie ist für den Nachweis von Tumoren <1,5 cm geeignet.
Somatostatinrezeptor-PET:
Die Somatostatinrezeptor 68Gallium-DOTATOC oder DOTA-NOC Positronen-Emissionstomographie(PET) ist zurzeit aufgrund der sehr hohen Empfindlichkeit und des extrem hohen Tumorkontrasts das sensitivste bildgebende Verfahren zum Nachweis neuroendokriner Tumoren. Die Untersuchungszeit beträgt maximal 3h, während die Octreotidszintigraphie sich über 2 Tage erstreckt. Mit der 68Gallium–DOTANOC Rezeptor PET ist die Detektion von Tumoren <1cm möglich. Ein weiterer Vorteil ist die erheblich geringere Strahlenexposition.
Eine chirurgische Resektion des Tumors ist die Therapie der Wahl soweit der Gesamtzustand des Patienten diese zulässt. Ziel ist die Blockresektion mit vollständiger Entfernung des neuroendokrinen Tumors unter Erhaltung von möglichst viel funktionellem Lungengewebe.
Therapie
Operation:
Eine chirurgische Resektion des Tumors ist die Therapie der Wahl soweit der Gesamtzustand des Patienten diese zulässt. Ziel ist die Blockresektion mit vollständiger Entfernung des neuroendokrinen Tumors unter Erhaltung von möglichst viel funktionellem Lungengewebe.
Chemotherapie:
Patienten mit metastasierenden neuroendokrinen Tumoren der Lunge werden oft mit einem Chemotherapieprotokoll, ähnlich dem des SCLC, behandelt (z.B. Cisplatin in Kombination mit Etoposid oder Cisplatin in Kombination mit Paclitaxel). Auch auf Streptozotozin basierende Chemotherapien werden empfohlen, weisen jedoch eine eingeschränkte Wirksamkeit auf.
Biotherapie:
Die Effektivität von a-Interferon und Octreotid bei Lungenkarzinoiden ist sehr begrenzt da nur wenige Patienten darunter einen stabilen Krankheitsverlauf aufweisen. Der Stellenwert liegt überwiegend beim klassischen Karzinoidsyndrom in einer Symptombesserung.
Radiorezeptortherapie:
Im Falle eines nicht-operablen, metastasierten Somatostatinrezeptor-positiven neuroendokrinen Tumors der Lunge führt eine Peptidrezeptor-vermittelte Radiotherapie mit an Octreotate gekoppeltem 90Yttritium (DOTATOC oder DOTATATE) bei mehr als der Hälfte der Patienten zu einem Ansprechen und einer Symptombesserung.
Prognose:
Typische bronchiale Karzinoide haben eine gute Prognose, nur 1 – 2% der Karzinoide rezidivieren. Die 5-Jahresüberlebensrate liegt zwischen 75 und 100%.
Eine unvollständige Resektion ist mit einer signifikant schlechteren Prognose assoziiert. Atypische Karzinoide haben eine große Tendenz zu metastasieren. Die 5-Jahresüberlebensrate variiert zwischen 30 und 65%. Die Prognose verschlechtert sich bei postitivem nodalen Stadus bei den atypischen Karzinoiden nicht jedoch bei den typischen Karzinoiden.
Kombinierte Schlafapnoe
Wenn häufige Atemstillstände im Schlaf zu einem fragmentierten und nicht erholsamen Schlaf führen, so spricht man von einem Schlafapnoe-Syndrom. Vereinzelte Atempausen, die im Schlaf nicht häufiger als fünfmal pro Stunde auftreten, sind dagegen unbedenklich und können auch im gesunden Schlaf beobachtet werden.
Kommen obstruktive und zentrale Schlafapnoe während der gleichen Schlafperiode vor, wird es als gemischtes oder kombinierte Schlafapnoe-Syndrom bezeichnet.
Kryptogen organisierende Pneumonie (COP)
Früher auch als Bronchiolitis organizing obstructive pneumonia (BOOP) bezeichnet.
Die kryptogen organisierende Pneumonie (COP) ist eine Form der organisierenden Pneumonien (OP) und zählt auch zur Gruppe der idiopathischen interstitiellen Pneumonien (IIP). Durch verschiedene Auslöser wie zum Beispiel Erreger oder Giftstoffe kommt es bei der COP zu einer überschießenden Reaktion des Immunsystems in der Lunge, die akute Entzündungsprozesse und den Umbau von Lungengewebe zur Folge hat.
Symptome
Eine kryptogen organisierende Pneumonie äußert sich meist mit folgenden Symptomen:
Fieber
Husten
Unwohlsein
Appetitlosigkeit
Gewichtsverlust
anhaltende, meist leichte Atemnot
Diagnose
Bei der ärztlichen Untersuchung kann unter anderem auch ein sogenanntes Knisterrasseln festgestellt werden. Lungenfunktionsmessungen ergeben meist eine restriktive Ventilationsstörung. Röntgen- oder Computertomographie (CT)- Untersuchungen helfen, weitere Hinweise auf eine COP-Erkrankung zu finden. Mittels mikroskopischer Untersuchungen des Lungengewebes nach bronchoskopischer Entnahme (Biopsie) kann zudem das Granulationsgewebe innerhalb der Lungenbläschen sichtbar gemacht werden.
Therapie
Eine COP-Erkrankung dauert meist wenige Monate an. Allerdings kann sich die endgültige Diagnose ‚kryptogen organisierende Pneumonie‘ leicht verzögern, da oft zunächst von einer ‚normalen‘ Lungenentzündung ausgegangen wird. Erst wenn eine Antibiotika-Therapie – die Standard-Behandlung bei Lungenentzündung - nicht wirkt, wird die COP in Betracht gezogen. Denn auch, wenn sie zum Teil große Ähnlichkeit mit einer Lungenentzündung aufweist, sind Antibiotika als Therapieansatz bei der COP wirkungslos.
Das Mittel der Wahl bei der Behandlung der kryptogen organisierenden Pneumonie sind Cortison-Präparate. Denn im Gegensatz zu anderen fibrosierenden Lungenerkrankungen ist die COP mit Cortison behandelbar. Und die meisten COP-Betroffenen sprechen gut auf die Therapie an, sodass die Veränderungen im Lungengewebe wieder rückgängig gemacht werden können. In bis zu 58 Prozent der Fälle kann es nach Abschluss der Behandlung zu einem Rückfall kommen, der jedoch durch erneute Cortison-Therapie behandelt werden kann.
Prognose
Bei bis zu 15 Prozent der Patienten schlägt die Therapie jedoch nicht an, und die Krankheit schreitet weiter voran. Die Vernarbung der Lunge (Lungenfibrose) breitet sich aus und führt zu Atembeschwerden und einem kontinuierlichen Rückgang der Lungenfunktion. Lungenfibrosen können bis heute leider nicht geheilt werden. Ziel der Therapie ist es deshalb, das Fortschreiten der Krankheit zu stoppen beziehungsweise zu verlangsamen und Beschwerden mit Hilfe einer symptomatischen Behandlung zu mindern. Mehr zur Therapie bei Lungenfibrose.
Die àrzte am LungenZentrum Hirslanden habe grosse Erfahrung in der Duagnose und Behandlung dieser Krankheit.
Lungenfibrose
Als Lungenfibrose wird eine Vernarbung der Lungen bezeichnet, welche durch Fasern von narbigfem Bindegewebe zustande kommt, welche das Gewebe der Lunge versteifen, die Struktur der Lungenbläschen (Alveolen) und zarten Blutgefässe (Kapillaren) zerstören (Lungeninsterstitium) und so den Gasaustausch zwisachen Atemluft und Blut behindern. Auch als interstitielle Lungenkrankheit bezeichnet, ws ein Sammelbegriff für über 200 verschiedene Lungenkrankheiten darstellt.
Die interstitielle Lungenkrankheit (engl. interstitial lung disease - ILD) beinhaltet ein weites Spektrum von Lungenkrankheiten mit unterschiedlichster klinischer Präsentation, mit unterschiedlichem Ansprechen auf Therapie und variabler Prognose. Sie stellt eine Herausfordung bezüglich weiterem diagnostischem Vorgehen dar und setzt eine enge Zusammenarbeit zwischen Pneumologen, Thoraxchirurgen, Radiologen und Pathologen voraus. Das multidisziplinäre Vorgehen ist der Grundpfeiler für eine optimale Diagnose und Ursachenfindung der Lungenfibrose.
Die idiopathische Lungenfibrose (IPF) tritt meistens im Erwachsenenalter zwischen 50 und 70 Jahren auf, vor allem bei aktiven oder ehemaligen Rauchern; Männer sind häufiger betroffen als Frauen.
IPF gehört zu einer großen Gruppe von etwa 200 Lungenerkrankungen, die das Interstitium, also das Bindegewebe zwischen den Lungenbläschen (Alveolen) befallen. Dennoch befallen diese Erkrankungen häufig nicht nur das Interstitium, sondern auch Lungenbläschen (Alveolen), periphere Atemwege (Bronchiolen) und Gefäße.Das Lungengewebe von Personen mit IPF weist ein charakteristisches histopathologisches Muster auf, das als gewöhnliche interstitielle Pneumonie (englisch Usual Interstitial Pneumonia oder UIP) bezeichnet wird. Das UIP-Muster ist die histologisch bzw. detailradiologische Entsprechung der IPF. In einer hochauflösenden Computertomographie (HRCT) kann ein typisches radiologisches Muster der UIP (usual interstital pneumonia) erkannt werden und bedarf keiner weiteren histologischen Verifizierung (bronchoskopische oder offene Lungenbiopsie).
Die Klassifikation der Lungenfibrose umfasst drei Hauptkategorien an IIPs: häufig auftretende IIPs, selten auftretende IIPs und nicht klassifizierbare IIPs. Zu den häufig auftretenden IIPs zählen chronisch fibrosierende IPs (darunter IPF und nichtspezifische interstitielle Pneumonie [NSIP]), rauchbedingte IPs (respiratorische Bronchiolitis mit interstitieller Lungenerkrankung [RB-ILD] und desquamative interstitielle Pneumonie [DIP]) sowie akute/subakute IPs (kryptogene organisierende Pneumonie [COP] und akute interstitielle Pneumonie [AIP].
Zur Diagnose der IPF müssen bekannte Ursachen von Lungenfibrosen ausgeschlossen werden. Beispiele für Lungenfibrosen mit bekannten Ursachen sind unter anderem hypersensitive Pneumonitis, Langerhans-Zell-Histiozytose, Asbestose und Kollagen-Gefäßkrankheit. Diese Krankheiten betreffen jedoch häufig nicht nur das Interstitium, sondern auch die peripheren Atemwege und Gefäße.
Klassifikation der Lungenfibrosen:
Medikamentöse Therapie der IPF
Pirfenidone: Pirfenidone (Esbriet®) war das erste Medikament, das speziell für die Behandlung der IPF entwickelt wurde und in Europa zugelassen ist. Es verfügt über antientzündliche, antioxidative und antifibrotische Eigenschaften und setzt daher an verschiedenen Stellen im Krankheitsprozess an. Es kommt bei Patientinnen und Patienten mit mildem bis mittelschwerem Krankheitszustand zum Einsatz. Zwingend erforderlich ist eine zuverlässige Diagnosestellung, am besten durch ein spezialisiertes Zentrum. Die durchgeführten Studien zeigen, dass unter Pirfenidone die Abnahme der Vitalkapazität deutlich geringer ausfällt als ohne Medikament. Auch ist der Prozentsatz der Patientinnen und Patienten, die 5 oder sogar mehr als 10% der VC in einem Jahr verlieren, unter Behandlung mit Pirfenidone deutlich geringer. Das ist von Bedeutung, da besonders jene Patientinnen und Patienten gefährdet sind, die einen raschen Lungenfunktionsverlust (>10% VC) erleiden. Schließlich ist auch die IPF-bezogene Mortalität unter Pirfenidone signifikant reduziert.
Bei der Behandlung mit Pirfenidone sind einige Besonderheiten zu berücksichtigen: Die Dosis wird langsam bis zur Zieldosis erhöht.
Während der Behandlung müssen regelmäßige Laborkontrollen zur Beurteilung der Leberfunktion durchgeführt werden. Das Medikament kann zu einer erhöhten Empfindlichkeit gegenüber Sonneneinstrahlung führen (Photosensibilitätsreaktion). Sonnenbaden (einschließlich Höhensonne!) sollte daher unbedingt vermieden und Sonnencremes mit hohem Lichtschutzfaktor (>30) konsequent verwendet werden.
Nintedanib (Ofev®):
Ist das zweite in der Schweiz zuggelassen Medikament für die Behandlung der IPF und ist für alle Schweregrade der Erkrankung zugelassen. Nintedanib ist ein intrazellulärer Multi-Tyrosin-Kinase-Inhibitor. Eine antifibrotische Wirkung erfolgt über die Blockade verschiedener Tyrosin-Kinase-Rezeptoren, denen eine pathogenetische Rolle bei der Entstehung der IPF zugeschrieben wird, wie dem „platelet-derived growth factor“ (PDGF), „fibroblast growth factor“ (FGF) und dem „vascular endothelial growth factor“ (VEGF). Es zeigte sich in den Studien ebenfalls eine signifikante Reduktion des Verlustes der FVC nach einem Jahr im Vergleich zu Patienten ohne dieses Medikament. Die Behandlung erfolgt in Kapselform mit zweimal täglicher Gabe (jeweils 150mg) alle 12 Stunden.
Die Kapseln sollten zu einer Mahlzeit eingenommen werden; sie sollten im Ganzen mit Wasser geschluckt und nicht zerkaut oder zerkleinert werden. Während der Behandlung müssen regelmäßige Laborkontrollen zur Beurteilung der Leberfunktion und der Nierenfunktion durchgeführt werden. Das Medikament kann zu Nebenwirkungen im Magen-Darm Bereich führen, insbesondere kann es zum vermehrten Auftreten von Durchfällen kommen, die aber mit geeigneten Medikamenten gut behandelbar sind. Über die Kombination der beiden Medikamente gibt es derzeit keine ausreichenden Daten.
Stellenwert anderer Medikamente bei IPF
Cortison: Cortison wird nicht mehr zur Behandlung der IPF empfohlen. Es kommt jedoch bei „akuten Exazerbationen“ in Ermangelung anderer Medikamente immer wieder zum Einsatz.
Azathioprin: Azathioprin wird zur Behandlung der IPF nicht mehr empfohlen, besonders nicht in Kombination mit Cortison und NAC. Bei Patientinnen und Patienten, die vor Bekanntwerden der ersten Ergebnisse der „Panther-Studie“ auf dieses Medikament eingestellt wurden und bei denen ein zufriedenstellender Krankheitsverlauf besteht, kann jedoch in Absprache mit den Betroffenen die Therapie weitergeführt werden.
Nicht empfohlene Medikamente
Tripple-Therapie: Die bis vor kurzem übliche „Tripple-Therapie“ mit N-Acetylcystein
(NAC, hochdosiert 3 x 600mg täglich), Cortison und Azathioprin ist für Patientinnen und Patienten mit neu diagnostizierter IPF nicht mehr zugelassen (Panther-Studie). Für Betroffene, die mit dieser Medikation bereits einen guten Krankheitsverlauf zeigen, sollte eine Änderung der Therapie jedoch sehr genau abgewogen werden. Bei anderen interstitiellen Lungenerkrankungen ist die Tripple Therapie - sofern notwendig - allerdings weiterhin erlaubt.
Drei Endothelinrezeptor-Antagonisten wurden bisher bei IPF getestet:
Bosentan (2 Studien) mit negativem Ergebnis, sowie Ambrisentan ebenfalls mit negativem Ergebnis.
Eine Studie mit der deutlich gewebegängigeren Substanz Macitentan, die beide Endothelin-Rezeptoren (A und B) hemmt und als erfolgsversprechende Substanz galt, zeigte keinen positiven Effekt; Macitentan ist daher ebenfalls nicht zur Behandlung der IPF zugelassen.
NAC: NAC ist ein Medikament, das häufig zur Behandlung von zähflüssigem Bronchialsekret bei Patientinnen und Patienten mit COPD eingesetzt wird, damit das Sekret leichter abgehustet werden kann. NAC hat jedoch auch eine antioxidative Potenz und wurde daher bei der IPF eingesetzt. Die Ergebnisse einer großen Studie wurden 2014 veröffentlicht und NAC zeigte keinen Vorteil im Vergleich zu Placebo. Daher sollte NAC zur Therapie der IPF nicht mehr eingesetzt werden.
Auch Interferon-Y-1B, Sildenafil, Etanercept und Imatinib werden als ungeeignet zur Behandlung der IPF eingestuft.
Nicht-medikamentöse Therapie der IPF
Langzeit-Sauerstofftherapie (LTOT: „long-term oxygen-treatment“):
Wenn bei Belastung oder auch bereits in Ruhe der Sauerstoffgehalt des Blutes unter einen bestimmten kritischen Wert sinkt, ist die Zufuhr von zusätzlichem Sauerstoff notwendig. Damit kann die Belastbarkeit der Patientinnen und Patienten erhöht werden beziehungsweise ist in vielen Fällen nur durch Sauerstoffzufuhr ein Belastungstraining überhaupt erst möglich. Speziell bei Entwicklung eines Lungenhochdrucks, der unter anderem wegen des Sauerstoffmangels bei vielen Formen der Lungenfibrosen auftreten kann, ist eine LTOT meist unverzichtbar.
Die LTOT wird vom Arzt/von der Ärztin verordnet und von der Krankenkasse bezahlt. LTOT hat eine nachgewiesene lebensverlängernde Wirkung, allerdings nur dann, wenn sie entsprechend der ärztlichen Verordnung verwendet wird. Therapieziel ist es, die Sauerstoffsättigung über 90% zu halten bzw. einen Sauerstoffpartialdruck im Blut von über 60mmHg zu erreichen. Die LTOT sollte unbedingt mindestens 16 Stunden pro Tag durchgeführt werden, wobei die Zufuhr von Sauerstoff für den Körper natürlich besonders dann unverzichtbar ist, wenn viel Sauerstoff verbraucht wird, also bei körperlicher Anstrengung! Dafür gibt es viele verschiedene Systeme. Ihr Arzt wird das für Sie geeignete System verordnen.
Lungentransplantation:
Eine Lungentransplantation ist eine Therapieoption, die nur für ausgesuchte Patientinnen und Patienten in Frage kommt, da der Eingriff nur bei Vorliegen definierter Transplant-Kriterien durchgeführt werden kann. Eine entscheidende Grundvoraussetzung ist absolute Nikotinkarenz. Das Rauchen muss nachweislich seit mindestens einem Jahr aufgegeben worden sein! Die Altersgrenze liegt gegenwärtig bei 65 Jahren, wobei es hier allerdings weniger um das tatsächliche Lebensalter als vielmehr um das biologische Alter geht. Weiters muss zwar einerseits die Lungenfunktion deutlich eingeschränkt sein, um für diese Therapie in Frage zu kommen, andererseits muss es der Gesamtzustand des Patienten/der Patientin erlauben, einen so schwerwiegenden Eingriff durchzuführen. Besonders wichtig ist daher die Erhaltung der körperlichen Fitness trotz der Erkrankung, wobei LTOT und Rehabilitation eine wesentliche Rolle spielen. Es ist entscheidend, dass der richtige Zeitpunkt für diese Behandlungsoption nicht übersehen wird, weshalb die engmaschige Betreuung in einem Fibrosezentrum mit rechtzeitiger Vorstellung an einem Transplant-Zentrum von zentraler Bedeutung ist.
Wie können Sie die Therapie zusätzlich unterstützen?
Patientinnen und Patienten, die an einer IPF leiden, können durchaus den Verlauf ihrer Lungenerkrankung positiv beeinflussen.
Das Rauchen aufgeben!
Rauchen ist ein bekannter Risikofaktor für die idiopathische Lungenfibrose (IPF). Das Fortschreiten der Krankheit wird durch das Rauchen beschleunigt. Deshalb wird allen Patientinnen und Patienten empfohlen, mit dem Rauchen aufzuhören.
Auch sollten verrauchte Räume und generell verschmutzte Luft aller Art gemieden werden.
Pulmonale Rehabilitation und allgemeine Fitness:
Die pulmonale Rehabilitation umfasst Bewegungstraining, Atemtechniken, medizinische Erziehung, Ernährungsberatung sowie emotionale Unterstützung und wird von einem Team aus Krankenpflegepersonal, Atem- und Physiotherapeuten, Sozialarbeitern und Diätetikern unterstützt. Die während der Rehabilitation gesteigerte Belastbarkeit sollte durch regelmäßige Übungen zu Hause möglichst lange aufrecht erhalten werden. Informationen über die pulmonale Rehabilitation finden Sie im nächsten Kapitel.
Ernährung:
Richtige Ernährung und gesundes Essen sind wichtig für die Gesundheit und das Wohlbefinden insgesamt. Patientinnen und Patienten mit einer IPF sollten versuchen, ein normales Körpergewicht zu erreichen oder aufrecht zu erhalten. Übergewicht bedeutet eine unnötige Belastung des Körpers und kann zu verstärkter Atemnot führen. Bei Untergewicht ist es dagegen schwieriger für den Organismus, sich gegen Infektionen zu wehren und daher sollte dieses ebenfalls vermieden werden. Zudem sind deutliches Über- und Untergewicht mögliche Ausschlussgründe für eine Lungentransplantation!
Impfungen:
Patientinnen und Patienten mit IPF leiden häufig an Atemwegsinfektionen. Ältere Erkrankte sollten daher darauf achten, sich regelmäßig impfen zu lassen. Eine Impfung gegen Lungenentzündung (Pneumokokken-Infektion) ist dabei ebenso empfehlenswert wie eine Grippeimpfung. Auch sollten nach Möglichkeit größere Menschenansammlungen gemieden werden, besonders in der kalten Jahreszeit. So können Sie Tröpfchen-infektionen der Atemwege vermeiden.
Ambulante und stationäre Rehabilitation
Neben den stationären pneumologischen Rehabilitationseinrichtungen (zB. Klinik Mammern) bietet das LungenZentrum Hirslanden auch ein ambulantes pulmonales Trainingsprogramm an. Aber das Wichtigste ist, Bewegung in den Alltag einzubauen, denn entscheidend sind nicht nur die wenigen Rehab-Wochen, sondern dass ein regelmäßiges Training ganzjährig durchgeführt wird. Der Trainingseffekt hält nämlich leider nicht an. Um die Leistungsfähigkeit nach einem Rehabilitationsaufenthalt zu erhalten, ist es notwendig, das Training fortzuführen. Jede Patientin und jeder Patient muss für sich selbst entscheiden, welche Trainings-/Bewegungsform für sie/ihn am besten ist, ob Radfahren bzw. Ergometer, Nordic Walken oder einfach gezieltes Gehen. Auch regelmäßiges Tanzen ist eine Bewegungsform, die vielen Spaß macht. Der große Vorteil beim Tanzen ist: Man ist nicht allein. Regelmäßige Bewegung und Training führen zu einer gesteigerten Leistungsfähigkeit und damit zu einer deutlich höheren Lebensqualität und Lebenserwartung!
Ihr Arzt im LungenZentrum Hirslanden kann Sie in der Diagnose, Behandlung und Rehabilitation der Lungenfibrose kompetent beraten!
Aktigraphie
Was ist Aktigraphie?
Immer mehr Menschen leiden an Schlafstörungen. Ob Probleme beim Einschlafen, häufiges Aufwachen oder nächtliches Wasserlassen, Störungen des Schlafes sind lästig und mindern die Konzentrations- und Leistungsfähigkeit. Bei einer Aktigraphie werden mit Hilfe eines Aktigraphen (Aktometer), einem armbanduhrähnlichen Messgerät, Bewegungen aufgezeichnet und so der Schlaf-Wach-Rhythmus ermittelt.
Wann ist eine Aktigraphie sinnvoll?
Oft steht man am Morgen auf und ist trotz ausreichend Schlaf müde und erschöpft. Schlafstörungen können sich in vielerlei Art und Weise äußern. Anhand der Beschwerden lassen sie sich jedoch meist nicht unterscheiden. Sie führen zu einer verminderten Konzentrations- und Leistungsfähigkeit, Abgeschlagenheit und oft zu einer erhöhten Reizbarkeit. Auch Kopfschmerzen und Verspannungen können Symptome einer Schlafstörung sein. Durch eine Aktigraphie kann ermittelt werden, um welche Art der Schlafstörung es sich handelt und diese gezielt behandelt werden.
Wie läuft eine Aktigraphie ab?
Das Aktometer wird über einen Zeitraum von zwei bis vier Wochen Tag und Nacht am Handgelenk getragen und dokumentiert die Messdaten meist in einminütigen Zeitintervallen. Da es sehr klein ist, stellt es im Alltag keine Behinderung dar. Zusätzlich zu den Bewegungen werden oft auch Umgebungstemperatur und Helligkeit aufgezeichnet, um ein umfangreiches Ergebnis zu erzielen. Nach dem genannten Zeitraum werden alle gemessenen und gespeicherten Daten ausgewertet und so der Schlaf-Wach-Rhythmus ermittelt. Dadurch kann ich bewerten, ob Sie in der Nacht eine erhöhte Aktivität aufweisen und Rückschlüsse auf Schlafdauer und Einschlafzeit ziehen.
Für wen ist eine Aktigraphie geeignet?
Eine Aktigraphie ist besonders für Schichtarbeiter oder Flugpersonal, die oft extremen Änderungen im Schlaf-Wach-Rhythmus ausgesetzt sind, empfehlenswert. Auch für Personen, die an Symptomen wie nächtlichem Schwitzen und Wasserlassen, Kopfschmerzen, verringerter Konzentrations- und Leistungsfähigkeit, Reizbarkeit oder Abgeschlagenheit leiden, ist eine Aktigraphie geeignet.
Bodyplethysmographie
Bodyplethysmografie, auch Ganzkörperplethysmografie oder große Lungenfunktion genannt; Methode, um das Residualvolumen, kurz RV genannt, zu bestimmen. RV ist das Volumen der Luft, die auch nach dem maximalen Ausatmen noch in den Lungen verbleibt. Die zu untersuchende Person sitzt in einer luftdicht abgeschlossenen Kammer mit bekanntem Volumen und atmet durch ein Mundstück. Auf beiden Seiten des Mundstücks messen Sensoren den Luftdruck, also den Druck in der Lunge und den Druck in der Kammer.
Während die Person normal atmet wird das Mundstück verschlossen. Die Person versucht einzuatmen, bekommt aber keine Luft. Trotzdem dehnt sich der Brustkorb (Thorax) etwas aus, und der Luftdruck in den Lungen nimmt ab. In der Kammer nimmt dagegen der Luftdruck etwas zu. Mit Hilfe der Werte, die sich aus diesen beiden änderungen des Drucks ergeben und die in einem bestimmten Verhältnis zu dem Volumen der Kammer stehen, lässt sich das Residualvolumen exakt berechnen. Die Bestimmung des Residualvolumens erlaubt die Berechnung der totalen Lungenkapazität (TLC). Mit einer Spirometrie (kleine Lungenfunktion) kann lediglich die Geometrie der Bronchien gemessen werden: Je eine Fluss- und eine Volumenkurve stellen (geometrisch) dar, wie schnell (Fluss) und wie viel (Volumen) Atemluft fließt.
Broncho-alveoläre Lavage
In Entwicklung
Bronchoskopie
In Entwicklung
Bronchoskopische Ballondilatation
In Entwicklung
Bronchoskopische Lungenvolumenreduktion
In Entwicklung
CO-Diffusionsmessung
In Entwicklung
CPAP-Therapie
In Entwicklung
Chirurgische Lungenvolumenreduktion
In Entwicklung
Diagnostische Bronchoskopie
Content
Elektromagnetische Navigations-Bronchoskopie
Elektromagnetische Navigations-Bronchoskopie (ENB)
Durch den Einsatz der Computertomographie (CT) der Lungen werden vermehrt kleine Lungenrundherde diagnostiziert, welche infolge Konfigurations- oder Grössenveränderung in der Verlaufscomputertomographie als karzinomverdächtig eingestuft werden. Zur Bestätigung des Karzinomverdachts mittels Gewebeentnahme standen bisher im inneren Drittel der Lunge die transbronchial entnommene Biopsie mittels Bronchoskopie in Sedation zur Verfügung, in den äusseren 2/3 der Lunge die thorakoskopische Gewebeentnahme von aussen in Narkose oder im äusseren Drittel der Lunge, die in Lokalanästhesie durchgeführte Computertomographie-geführte Nadel-Biopsie von aussen, beides deutlich invasivere Methoden.
Mit der elektromagnetischen Navigations-Bronchoskopie (ENB) oder auch Lung-GPS, steht nun eine minimal-invasive bronchoskopische Methode zur Verfügung, welche auch Gewebeentnahmen in bisher bronchoskopisch unzugänglichen Lokalisationen erlaubt.
Durch das ENB-System können computertomographische Daten des Patienten in eine dreidimensionale Navigationskarte umgewandelt werden, so dass die am Patienten angebrachten GPS-Sensoren eine exakte Steuerung des Bronchoskops erlaubt. Die durch das Bronchoskop eingeführte Biopsie-Sonde kann so exakt an die zu untersuchende Lungenveränderung navigiert werden. Die Anwendung der diagnostischen Bronchoskopie in Kombination mit dem ENB-System verbessert die Trefferquote für die Gewebeuntersuchungen deutlich und verhindert so unnötige Zweit- und Drittuntersuchungen.
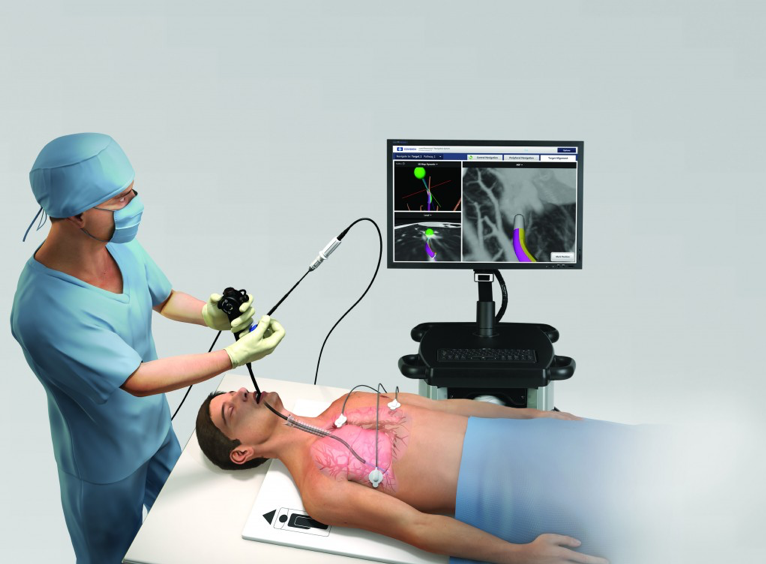
Die Durchführung der Untersuchung mittels dem ENB-System umfasst im Vorfeld der Untersuchung eine genaue Planung aus den CT Daten des Patienten. Dazu werden die zur Lungenveränderung führenden Atemwege dreidimensonal rekonstruiert, die Navigationswege zu den Zielpunkten markiert. Die virtuelle Bronchoskopie erlaubt dann ausserhalb des Patienten die Zielpunkte vor der eigentlichen Untersuchung am Patienten genau zu identifizieren und eine 3-D Simulation der geplanten Biopsie zu durchlaufen.
Während der eigentlichen Untersuchung am Patienten liegt der Patient auf einem Untersuchungstisch mit elektromagnetischer Platte, 3 GPS-Sensoren auf der Thoraxwand des Patienten angebracht, erlauben den GPS-Sensor an der Spitze des Bronchoskops im 3-D Raum der Lunge innerhalb der im CT identifizierten Atemwege genau zu navigieren und die Zielläsion mit grosser Trefferquote zu biopsieren.
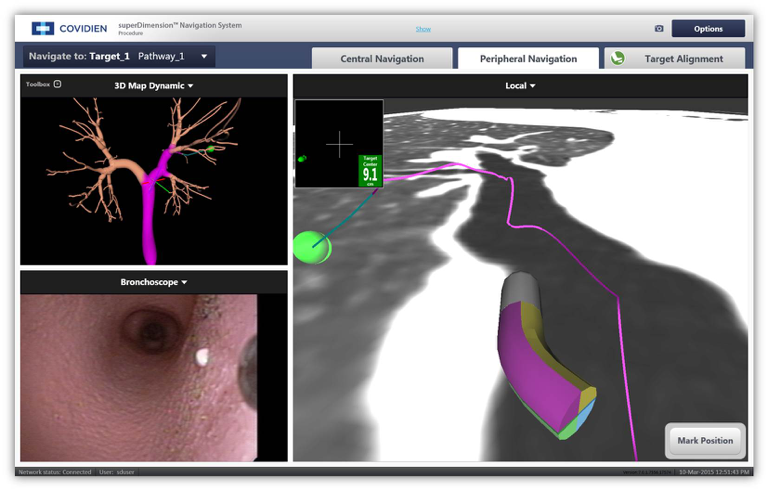
Das ENB-System eignet sich für weitere wichtige medizinische Anwendungen:
- Präoperative Markierung von Lungenläsionen
Im Vorfeld einer geplanten thorakoskopischen Lungen-Operation kann eine kleine Läsion für den Thoraxchirurgen endoskopisch Ziel-genau markiert werden. Lungenveränderungen, welche unterhalb der Lungenoberfläche liegen, sind oft für den Thoraxchirurgen nur schwer lokalisierbar.
- Markierung eines Tumors in der Lunge vor gezielter Bestrahlung
Zur Verbesserung der gezielten Bestrahlung von Lungentumoren mittels Cyperknife, ist die genaue Markierung der Tumornachbarschaft notwendig, so wird verhindert, dass während der Bestrahlung durch die Atembewegung auf gesundes Lungengewebe mitbestrahlt wird.
Endobronchiale Kryotherapie
In Entwicklung
Endobronchiale Lasertherapie
In Entwicklung
Endobronchiale Ultraschallbiopsie (EBUS)
Der Goldstandard für das Lungenkrebs-Staging
Die mittels endobronchialem Ultraschall gesteuerte transbronchiale Nadelaspiration (EBUS-TBNA) ist ein zuverlässiges und etabliertes Verfahren, das die Visualisierung und die Probenentnahme von mediastinalen, zentralen und hilären Läsionen und Lymphknoten im Trachobronchialbaum ermöglicht.
Das in die Luft- oder Speiseröhre eingeführte Ultraschall-Bronchoskop macht es möglich, die zugänglichen Lymphknotenstationen zu untersuchen und die Läsionen abzugrenzen, und bietet gleichzeitig die Freiheit, EBUS-Nadeln je nach Bedarf in unterschiedlicher Ausführung und Größe auszuwählen.
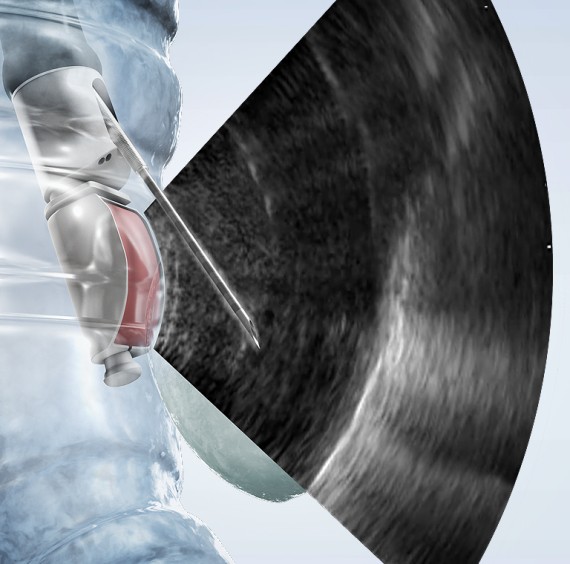
Die EBUS-TBNA hat sich nicht nur beim Lymphknoten-Staging (N-Staging) als überaus hilfreich erwiesen, sondern auch bei der strategischen Nutzung von Zytologie- und Histologieproben für die Molekularanalyse. Die gewonnenen Proben können für eine zuverlässige Diagnose sowie für die Zellblockpräparation, die Immunchemie und für molekulare Studien verwendet werden.
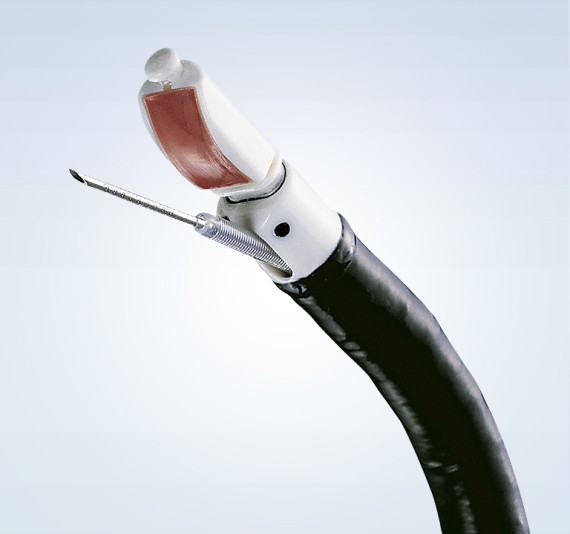
Flexible Bronchoskopie
In Entwicklung
Früherkennung von Lungenkrebs
In Entwicklung
Heim-Sauerstofftherapie
In Entwicklung
Inhalationstechniken
Im folgenden stellen wir Ihnen mit kurzen Filmen die Handhabung von verschiedenen Inhalationsgeräten vor:
Turbuhaler
Folgende Medikamente werden durch den Turbuhaler inhaliert:
Bricanyl®, Oxis®, Pulmicort®, Rhinocort® und Symbicort®
Ellipta
Folgende Medikamente werden durch den Ellipta inhaliert:
Anoro®, Arnuity®, Breo®, Incruse®, Relvar®, Trelegy®, Vilanterol®
Diskus
Folgende Medikamente werden durch den Diskus inhaliert:
Serevent®, Axotide®, Seretide®
Breezhaler
Folgende Medikamente werden durch den Aerolizer inhaliert:
Foradil®, Miflonide®, Onbrez®, Seebri®, Ultibro®
Kognitive Verhaltenstherapie
In Entwicklung
Künstliche Beatmung
In Entwicklung
Lagetraining
In Entwicklung
Lungenfunktion
In Entwicklung
Metacholin-Bronchoprovokationstest
In Entwicklung
Multipler Schlaf-Latenztest
In Entwicklung
Navigations-Bronchoskopie
Elektromagnetische Navigations-Bronchoskopie (ENB)
Durch den Einsatz der Computertomographie (CT) der Lungen werden vermehrt kleine Lungenrundherde diagnostiziert, welche infolge Konfigurations- oder Grössenveränderung in der Verlaufscomputertomographie als karzinomverdächtig eingestuft werden. Zur Bestätigung des Karzinomverdachts mittels Gewebeentnahme standen bisher im inneren Drittel der Lunge die transbronchial entnommene Biopsie mittels Bronchoskopie in Sedation zur Verfügung, in den äusseren 2/3 der Lunge die thorakoskopische Gewebeentnahme von aussen in Narkose oder im äusseren Drittel der Lunge, die in Lokalanästhesie durchgeführte Computertomographie-geführte Nadel-Biopsie von aussen, beides deutlich invasivere Methoden.
Mit der elektromagnetischen Navigations-Bronchoskopie (ENB) oder auch Lung-GPS, steht nun eine minimal-invasive bronchoskopische Methode zur Verfügung, welche auch Gewebeentnahmen in bisher bronchoskopisch unzugänglichen Lokalisationen erlaubt.
Durch das ENB-System können computertomographische Daten des Patienten in eine dreidimensionale Navigationskarte umgewandelt werden, so dass die am Patienten angebrachten GPS-Sensoren eine exakte Steuerung des Bronchoskops erlaubt. Die durch das Bronchoskop eingeführte Biopsie-Sonde kann so exakt an die zu untersuchende Lungenveränderung navigiert werden. Die Anwendung der diagnostischen Bronchoskopie in Kombination mit dem ENB-System verbessert die Trefferquote für die Gewebeuntersuchungen deutlich und verhindert so unnötige Zweit- und Drittuntersuchungen.

Die Durchführung der Untersuchung mittels dem ENB-System umfasst im Vorfeld der Untersuchung eine genaue Planung aus den CT Daten des Patienten. Dazu werden die zur Lungenveränderung führenden Atemwege dreidimensonal rekonstruiert, die Navigationswege zu den Zielpunkten markiert. Die virtuelle Bronchoskopie erlaubt dann ausserhalb des Patienten die Zielpunkte vor der eigentlichen Untersuchung am Patienten genau zu identifizieren und eine 3-D Simulation der geplanten Biopsie zu durchlaufen.
Während der eigentlichen Untersuchung am Patienten liegt der Patient auf einem Untersuchungstisch mit elektromagnetischer Platte, 3 GPS-Sensoren auf der Thoraxwand des Patienten angebracht, erlauben den GPS-Sensor an der Spitze des Bronchoskops im 3-D Raum der Lunge innerhalb der im CT identifizierten Atemwege genau zu navigieren und die Zielläsion mit grosser Trefferquote zu biopsieren.

Das ENB-System eignet sich für weitere wichtige medizinische Anwendungen:
- Präoperative Markierung von Lungenläsionen
Im Vorfeld einer geplanten thorakoskopischen Lungen-Operation kann eine kleine Läsion für den Thoraxchirurgen endoskopisch Ziel-genau markiert werden. Lungenveränderungen, welche unterhalb der Lungenoberfläche liegen, sind oft für den Thoraxchirurgen nur schwer lokalisierbar.
- Markierung eines Tumors in der Lunge vor gezielter Bestrahlung
Zur Verbesserung der gezielten Bestrahlung von Lungentumoren mittels Cyperknife, ist die genaue Markierung der Tumornachbarschaft notwendig, so wird verhindert, dass während der Bestrahlung durch die Atembewegung auf gesundes Lungengewebe mitbestrahlt wird.
Nicht-invasive Beatmung
In Entwicklung
Nächtliche Langzeitpulsoxymetrie
In Entwicklung
Offene Operationen
In Entwicklung
Polygraphie
In Entwicklung
Polysomnographie
In Entwicklung
Polysomnographie
In Entwicklung
Protrusionsschiene
In Entwicklung
Pulmonale Rehabilitation
In Entwicklung
Radialer endobronchialer Ultraschall (Minisonde)
In Entwicklung
Rauchstoppberatung
In Entwicklung
Roboter-assistierte Operationen
In Entwicklung
Starre Bronchoskopie
In Entwicklung
Therapeutische Bronchoskopie
In Entwicklung
Thorakoskopie
In Entwicklung
Transbronchiale Kryobiopsie
In Entwicklung
Vasodilatations-Therapie
In Entwicklung
Video-assistierte thorakoskopische Operationen
In Entwicklung
Behandeln Sie auch allgemeinversicherte Patienten?
Ja.
Ambulante Patienten werden unabhängig von Ihrer Versicherungsklasse in den Praxen des LungenZentrum Hirslanden behandelt.
Allgemeinversicherte stationäre Patienten können im Kanton Zürich nur an der Klinik Hirslanden aufgenommen werden, alle anderen Privatkliniken bieten diese Aufnahmemöglichkeit nicht an!
Welche Pneumologen sind an der Klinik Hirslanden tätig?
Das LungenZentrum Hirslanden wurde Mitte 1998 gegründet und ist seit über 20 Jahren für die umfassende Betreuung von allen Patienten mit Lungenerkrankungen an der Klinik Hirslanden verantwortlich. Wir haben bewusst unsere medizinischen Service auf die Klinik Hirslanden ausgerichtet und sind nicht noch an anderen Kliniken tätig. Wir sind auch im Notfall für Sie jederzeit verfügbar.
Das pneumologische Ärzteteam umfasst:
Dr. med. Jürg Barandun
Dr. med. Karl Klingler
Dr. med. Andreas Piecyk
Wir sind 365 Tage, 24h für Sie da!
Es besteht eine enge Zusammenarbeit mit den Thoraxchirurgen des Chirurgischen Zentrum Zürich:
Prof. Dr. med. Othmar Schöb
Prof. Dr. med. Rolf Schlumpf
Prof. Dr. med. Paul Schneider
Es besteht eine enge Zusammenarbeit mit dem Zentrum für Schlafmedizin:
Dr. phil. Daniel Brunner
li. phil. Daniela Jansen-Müller
PD Dr. med. Rositsa Neumann
Das LungenZentrum steht allen Patienten im ambulanten und stationären Setting unabhängig von der Versicherungsklasse zur Verfügung.
Muss ich durch den Hausarzt zugewiesen werden?
Nein, es besteht auch die Möglichkeit sich direkt bei uns anzumelden.
Es liegt uns viel an einer engen Zusammenarbeit mit Ihrem Hausarzt, weshalb es empfehlenswert ist, Ihren Hausarzt zu informieren. Insbesondere wenn Sie in einem Hausarztmodell versichert sind, muss die Zuweisung über Ihren Hausarzt erfolgen. Normalerweise erstellen wir nach Diagnose und Therapieeinleiting einen Hausarztbericht, den wir Ihnen auch gerne in Kopie zustellen.
Kann ich auch ohne Termin vorbeikommen?
Ja, in Notfallsituationen dürfen Sie auch ohne Termin vorbeikommen. Um längere Wartezeiten zu verhindern, empfehlen wir ein kurzes Telefonat mit unserem Empfang Tel. 044/387 30 00. Wir bemühen uns jederzeit, so effizient wie möglich zu arbeiten und Ihre Wartezeit so kurz wie möglich zu halten.
Wenn ich hospitalisiert bin, sind die Ärzte des LungenZentrums verfügbar?
Ja, Ihre Sicherheit ist uns sehr wichtig, es ist immer ein Arzt des LungenZentrums während den Sprechstundenzeiten im Hause. Wir haben bewusst verzichtet in anderen Kliniken gleichzeitig tätig zu sein, da dadurch die Kontinuität der Behandlung nicht zu jedem Zeitpunkt durch einen Facharzt gewährleistet wird.
Soll ich mich gegen Grippe impfen?
1. Warum gegen Grippe impfen?
Die alljährliche Grippeimpfung im Herbst bietet (zusammen mit allgemeinen Hygienemassnahmen wie Händedesinfektion, Husten- und Niesdisziplin) den bestmöglichen Schutz vor der Grippe und ihrer Komplikationen im bevorstehenden Winter.
2. Welches sind die Zielgruppen für eine Grippeimpfung?
a. Personen mit erhöhtem Risiko für Grippekomplikationen: Senioren ab 65 Jahren, Patienten mit chronischen Erkrankungen, Frühgeborene ab dem 6. Lebensmonat für die ersten zwei Winter nach der Geburt und Schwangere (während der gesamten Schwangerschaftsdauer),
b. sowie deren Kontaktpersonen in Beruf und Familie (z.B. Medizinal-, Pflege- und Krippenpersonal, Tagesmütter oder im selben Haushalt lebende Personen)
c. und Personen, die regelmässigen Kontakt mit Säuglingen unter 6 Monaten haben.
Alle übrigen Personen, welche sich aus beruflichen oder privaten Gründen schützen möchten, können selbstverständlich ebenfalls vom Angebot am Nationalen Grippeimpftag profitieren.
3. Was ist der Nationale Grippeimpftag und wer organisiert ihn?
a. Der Nationale Grippeimpftag soll als besonders sichtbarer Event zu Beginn der
Grippesaison den Sinn und den Zeitpunkt der Grippeimpfung in Erinnerung rufen. Zudem können sich alle Impfinteressierten an diesem Tag überall in der Schweiz (ohne Voranmeldung bei den teilnehmenden Praxen und zu einem empfohlenen Pauschalpreis von 30 CHF) impfen lassen.
b. Der Grippeimpftag wird vom Kollegium für Hausarztmedizin in Zusammenarbeit mit den Fachgesellschaften der Schweizerischen Haus- und KinderärztInnen (SGAIM und SGP) organisiert und logistisch sowie finanziell unterstützt vom Bundesamt für Gesundheit (BAG). Im Jahr 2018 findet er am Freitag, 9. November statt.
4. Wie und wo kann ich mich am Grippeimpftag impfen lassen?
Interessierte Personen können die Adressen impfender HausärztInnen in ihrer Umgebung bequem auf der Website des Kollegiums für Hausarztmedizin (via Startseite) finden (ab September verfügbar). Nach kurzer Befragung und Information über die Grippeimpfung wird der Interessent vom Arzt oder einer Praxisassistentin geimpft. Der empfohlene Pauschalpreis (30 CHF) ist danach bar zu bezahlen. Personen mit einem erhöhten Komplikationsrisiko können sich den Betrag von ihrer Krankenkasse rückerstatten lassen (sofern die Franchise bereits erreicht wurde).
Soll im mich gegen die Lungenentzündung impfen?
Impfung gegen Pneumokokken verfügbar.
Pneumokokken-Erkrankungen werden durch Bakterien aus der Familie der Streptokokken hervorgerufen. Sie sind weltweit verbreitet und werden von Mensch zu Mensch übertragen. Je nach Region der Welt und abhängig vom Alter sind verschiedene Pneumokokken-Stämme für unterschiedliche Krankheiten mit zum Teil lebensbedrohlichen Verläufen verantwortlich. So verursachen sie beispielsweise die Mehrzahl aller bakteriellen Lungenentzündungen.
Pneumokokken werden wie ein grippaler Infekt durch Tröpfcheninfektion übertragen - beispielsweise beim Husten oder Niesen. Die Bakterien finden sich im Nasen-Rachen-Raum vieler Menschen, ohne dass diese daran erkranken. Daher können sie auch von Gesunden weitergegeben werden.
Warum Pneumokokken bei manchen Menschen plötzlich Krankheiten auslösen und bei anderen nicht, ist nicht genau bekannt. Auch Gesunde können betroffen sein. Bei geschwächter Körperabwehr – zum Beispiel nach einer Viruserkrankung oder bei chronischen Erkrankungen – passiert dies jedoch leichter. Säuglinge und Kleinkinder sowie auch ältere Menschen erkranken häufiger an Pneumokokken. Denn mit zunehmendem Alter lassen die Abwehrkräfte des Körpers nach und chronische Krankheiten nehmen zu.
Pneumokokken können verschiedene Erkrankungen auslösen - darunter Nasennebenhöhlen-, Mittelohr-, Hirnhautentzündung oder Blutvergiftung. Darüber hinaus sind sie für 20 bis 50 Prozent aller durch Bakterien verursachten Lungenentzündungen bei älteren Erwachsenen verantwortlich. Einige dieser Erkrankungen können lebensbedrohlich verlaufen. Bei schwerem Verlauf stirbt etwa jeder Zehnte der Erkrankten an den Folgen der Pneumokokken-Infektion. Besonders gefährdet sind Menschen mit geschwächtem Immunsystem.
Pneumokokken-Erkrankungen können zwar mit Antibiotika behandelt werden. Allerdings nehmen Resistenzen zu, so dass die Medikamente schlechter anschlagen. Der Schutz durch Impfung wird daher immer wichtiger.
Die Pneumokokkenimpfung ist in erster Linie indiziert für Personen jeden Alters mit erhöhtem Risiko einer Pneumokokkenerkrankung oder bei über 65-Jährigen von uns empfohlen:
Chronische Krankheiten:
- Herzinsuffizienz
- Chronisch obstruktive Lungerkrankung (COPD), schweres Asthma, Bronchiektasen durch Antikörpermangel
- Leberzirrhose
- Anatomische und funktionnelle Asplenie, Sichelzellanämie
- Niereninsuffizienz, nephrotisches Syndrom
- Schlecht eingestellter Diabetes mit Herz- oder Niereninsuffizienz
Neoplasien: Lymphome, Leukämie, Myelome
Transplanation: Kandidaten und Empfänger einer solide Organtransplantation, Stammzellenempfänger
Störungen des Immunsystems:
- Autoimmunerkrankungen, die wahrscheinlich eine Immunsuppression erfordern
- Medikamentöse Immunsuppression
- HIV-Infektion
- Immundefizienz, z.b. Variables Immundefektsyndrom, Polysaccharid-Antikörpermangel
Frühgeburt (< 33. Schwangershaftwoche oder Geburtsgewicht < 1500g)
Cochleaimplantat (in situ oder geplant)
Schädelbasisfraktur / -Missbildung
Nebenwirkungen:
Häufig kommt es durch die Anregung der körpereigenen Abwehr zu einer Rötung oder Schwellung an der Einstichstelle, die auch schmerzen kann. Ebenso können in den ersten drei Tagen nach der Impfung Allgemeinsymptome wie beispielsweise Fieber, Kopfschmerzen, Abgeschlagenheit, Muskel- und Gelenkschmerzen auftreten. Solche Impfreaktionen klingen in der Regel nach ein bis drei Tagen wieder ab.
Schwere Nebenwirkungen sind selten. Eine allergische Reaktion (z. B. Nesselsucht) ist möglich. Sehr selten kann sich die Zahl der Blutplättchen (verantwortlich für die Blutgerinnung) vorübergehend verringern.
Impfstoffe:
In der Schweiz sind 2 Impfstoffe für Erwachsene verfügbar. Pneumovax (23-valent) muss alle 5-6 Jahre wiederholt werden oder Prevenar (13-valent) muss nur 1x verabreicht werden, wird nicht wiederholt. Es muss aber bei diesem Impfstoff (Prevenar) ein Abstand von 1 Jahr zu einer Pneumovax-Impfung eingehalten werden, kann aber gleichzeitig mit einer Grippe-Impofung verabreicht werden.